Epidemiología, características clínicas y factores pronósticos de los episodios de bacteriemia causados por enterobacterias productoras de betalactamasas de espectro extendido
González-Gasca, FJ*; Castón-Osorio, JJ; Porras-Leal, L*; Ros-Izquierdo, J*; Portillo J*; Martínez, J**; Romero MD**; dela Rocha-Vedia, I*; Clemente-Tomé, I*; Monroy, C*; Gijón, JA* *Servicio de Medicina Interna. **Unidad de Microbiología. Hospital General Universitario de Ciudad Real C/ Obispo Rafael Torija, sn CP 13005 Ciudad Real . (España)
RESUMEN
Objetivos: Conocer la epidemiología, características clínicas y factores pronósticos de los pacientes con bacteriemia por enterobacterias productoras de betalactamasas de espectro extendido (BLEE).
Metodología: Estudio retrospectivo de cohortes. Se incluyeron todos los pacientes mayores de 18 años que presentaron bacteriemia producida por enterobacterias productoras de BLEE entre el 1 de octubre de 2006 y el 30 de septiembre de 2010 en el Hospital General Universitario de Ciudad Real. Se recogieron variables clínicas y se realizó un análisis multivariante para estudiar los factores asociados a mortalidad.
Resultados: Se incluyeron 51 episodios de bacteriemia. La edad media fue 70,39 años. El aislamiento más frecuente fue Escherichia coli (E. coli) (n= 43; 84,3%). 7 (13,7%) presentaron bacteriemia polimicrobiana. 28 (54,9%) habían estado hospitalizados previamente. El foco más frecuente fue el urinario (n= 22; 43,1%). 26 de los pacientes (51%) fue tratado empíricamente inadecuadamente. 17 (33,3%) fallecieron a los 30 días de la bacteriemia. La pluripatología asociada a la bacteriemia (OR: 4,818; IC95% 1,376-16,869; p=0,014) fue factor de riesgo de mortalidad por bacteriemia producida por enterobacterias productoras de BLEE. La intervención quirúrgica previa (OR: 0,114; IC95%: 0,014-0,898; p=0,039) y la infección de origen urinario (OR: 0,191; IC95%: 0,055-0,664; p=0,009) se asociaron a menor mortalidad.
Conclusiones: La bacteriemia por enterobacterias BLEE se asocia a una alta mortalidad. E. coli representa la enterobacteria productora de BLEE más frecuente en nuestro medio. Los pacientes con mayor riesgo de mortalidad en una bacteriemia por enterobacterias productora de BLEE son aquellos con mayor pluripatología de base. El origen urinario y los pacientes con intervención quirúrgica previa se asociaron con menor mortalidad.
ABSTRACT
Epidemiology, clinical features and prognostic factors of the episodes of bacteremia caused by extended-spectrum beta-lactamases producing Enterobacteriaceae.
Objectives: To know the epidemiology, clinical features and prognostic factors of patients with bacteremia due to extended-spectrum beta-lactamase (ESBL)-producing Enterobacteriaceae.
Methodology: Retrospective cohort study. All patients older than 18 who had one episode of bacteremia caused by ESBL-producing Enterobacteriaceae at Hospital General Universitario de Ciudad Real between October 1, 2006 and September 30, 2010 were included. Clinical variables were collected and multivariate analysis was performed to examine the factors associated with mortality.
Results: 51 bloodstream infections were detected. The mean age was 70.39 years. The most commonly isolated was Escherichia coli (E. coli) (n= 43; 84.3%). 7 (13.7%) presented a polymicrobial bacteremia. 28 (54.9%) had been hospitalized previously. The most common focus was the urinary tract (n=22; 43.1%). 26 patients (51%) were empirically treated inappropriately. 17 (33.3%) died within 30 days after bacteremia. Multivariate analysis showed that pluripathological patient was an independent factor of mortality at 30 days (OR: 4.818; 95%CI: 1.376-16.869; p=0.014). Previous surgical intervention (OR: 0.114; 95%CI: 0.014-0.898; p=0.039) and infection of urinary origin (OR: 0.191; 95%CI: 0.055-0.664; p=0.009) were associated with lower mortality.
Conclusions: Bacteremia by ESBL-producing Enterobacteriaceae is associated with high mortality. E. coli represents the most frequent ESBL-producing Enterobacteriaceae in our environment. Patients at increased risk of mortality in ESBL-producing Enterobacteriaceae bacteremia are those with previous pluripathology. Urinary focus and surgical intervention previous bacteremia are associated with lower mortality.
INTRODUCCIÓN
Las enterobacterias constituyen un grupo heterogéneo de bacilos gram-negativos (1), las cuales son la principal causa de bacteriemia comunitaria, así como una importante causa de bacteriemia nosocomial. Los pacientes hospitalizados, los asistidos en centros socio-sanitarios, los inmunodeprimidos y los que han recibido antibióticos recientemente son particularmente susceptibles a la colonización e infección por estas enterobacterias (2).
En los últimos años, se ha observado una creciente aparición de bacteriemias originadas por cepas de enterobacterias productoras de betalactamasas de espectro extendido (BLEE) especialmente en aquellos pacientes con importantes comorbilidades, institucionalizados o que han recibido previamente tratamiento con cefalosporinas (5, 6). En un estudio español realizado en 2009, las cepas de E. coli productora de BLEE supusieron el 4,04% del total de E. coli aisladas en hemocultivo (7). El aumento en la frecuencia de estas enterobacterias supone un importante problema clínico debido a que las BLEE confieren resistencia a penicilinas y cefalosporinas y, se asocian frecuentemente con resistencia a fluorquinolonas, aminoglucósidos y cotrimoxazol (5, 6), los cuales son antibióticos frecuentemente empleados en el tratamiento empírico de los pacientes con bacteriemia tanto comunitaria como nosocomial.
La eficacia del tratamiento empírico inicial resulta decisiva para la supervivencia del paciente que presenta una infección por estas enterobacterias. De hecho, existen numerosos estudios que describen una asociación significativa entre tratamiento empírico inadecuado y aumento de la mortalidad en pacientes con bacteriemias producidas por enterobacterias productoras de BLEE (8). En 2010, Rodríguez-Baño et al en un estudio multicéntrico español, recogió una mortalidad cruda del 30% y un tratamiento empírico inadecuado en la mitad de los casos (9).
Además del tratamiento empírico inadecuado, otras variables, como la patología de base o el foco de origen de la bacteriemia, podrían influir en el pronóstico de estos pacientes. Por ello, realizamos un estudio con el objetivo de estudiar las características clínicas de los pacientes con bacteriemia causada por enterobacterias productoras de BLEE y determinar los factores pronósticos relacionados con mayor mortalidad.
MATERIAL Y MÉTODOS
Diseño: Se trata de un estudio retrospectivo de cohortes realizado en el Hospital General Universitario de Ciudad Real, hospital español de tercer nivel y dotado con 540 camas. Se incluyeron todos los pacientes mayores de 18 años que presentaron al menos un episodio de bacteriemia producida por enterobacterias productoras de BLEE entre el 1 de octubre de 2006 y el 30 de septiembre de 2010.
Variables: Se recogieron las siguientes variables: edad, sexo, comorbilidades (diabetes mellitus, cardiopatía isquémica, insuficiencia cardiaca, broncopatía crónica, enfermedad hepática crónica, neoplasia sólida, neoplasia hematológica, insuficiencia renal crónica, hemodiálisis, cirugía en los 30 días previos), paciente pluripatológico (definido como la existencia de 2 o más comorbilidades de las descritas previamente), procedimientos invasivos durante el mes previo al episodio de bacteriemia, días de estancia hospitalaria, lugar de adquisición de la bacteriemia (nosocomial, comunitaria o asociada a los cuidados sanitarios) según los criterios del Center for Disease Control (CDC) (10), la antibioterapia recibida en los 30 días previos a la aparición de la bacteriemia, bacteriemia polimicrobiana, gravedad de la bacteriemia según el índice de Pitt (11), foco de bacteriemia según los criterios del CDC (12, 13), nutrición parenteral, tratamiento previo con esteroides (dosis equivalente igual o superior a 15 mg de prednisona), neutropenia (<500 neutrófilos/mm3), tratamiento antimicrobiano recibido, tipo de enterobacteria, patrón de resistencias antimicrobianas y mortalidad a los 30 días del episodio de bacteriemia (variable principal).
Métodos microbiológicos: Los hemocultivos se obtuvieron por venopunción en dos puntos distintos. El cultivo se realizó en medios convencionales. La detección de enterobacterias productoras de BLEE se efectuó mediante la interpretación de antibiogramas realizados por microdilución, siguiendo las recomendaciones del Clinical and Laboratory Standard Institute (CLSI). Las concentraciones mínimas inhibitorias (CMI) informadas como intermedias se consideraron como resistentes. El equipo técnico se compone por Siemens Microscan © Panels Negative Combo 36 – 37. (Siemens Healthcare Diagnostics).
Análisis estadístico: Se calcularon frecuencias y porcentajes para las variables cualitativas. Las variables cuantitativas se expresaron mediante media ± desviación típica con intervalos de confianza del 95%. Las variables continuas se compararon mediante la prueba t de Student o la U de Mann-Whitney y las variables cualitativas con la prueba de Chi-cuadrado y el test exacto de Fisher. Se consideró estadísticamente significativo una P bilateral <0,05. Para calcular los factores asociados independientemente a mal pronóstico en pacientes con bacteriemia por enterobacterias productoras de BLEE, se realizó en primer lugar un análisis univariante con cada una de las variables obtenidas, tomando como variable dependiente la mortalidad a los 30 días del episodio de bacteriemia. Posteriormente, se efectuó un análisis multivariante mediante regresión logística múltiple, incluyendo las variables con un valor de p<0.15 y aquellas que se consideraron clínicamente relevantes. El grado de asociación se determinó mediante la odds ratio con intervalos de confianza del 95%. El análisis se realizó con el programa PAWS (versión 18.0; Chicago, IL, USA).
RESULTADOS
Se detectaron 51 pacientes con bacteriemia por enterobacteria BLEE. La edad media fue de 70,39 años (rango: 29-92). El 62,7% (n=32) fueron varones. El 33,3% (n=17) de los pacientes falleció en los 30 días siguientes a la bacteriemia. El aislamiento más frecuente fue E. coli (n= 43; 84,3%), seguida de K. pneumoniae (n=6; 11,7%), presentándose bacteriemia polimicrobiana en un 13,7% (n=7) de los casos (Tabla 1).
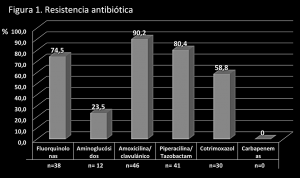
El 54,9% (n=28) de los pacientes habían estado hospitalizados previamente. La principal enfermedad de base fue la neoplasia, tanto hematológica como de órgano sólido (n=22; 43,2%), seguida de broncopatía crónica, diabetes mellitus y enfermedad renal crónica (n=16; 31,4% cada uno). El 19,6% (n=10) de los pacientes presentaba sondaje vesical. El foco más frecuente fue el urinario (n=22; 43,1%), seguido del abdominal (n=11; 21,6%). El 51% (n=26;) de los pacientes fue tratado empíricamente inadecuadamente. La resistencia antibiótica más común fue a amoxicilina/clavulánico (n=46; 90,2%), piperacilina/tazobactam (n=41; 80,4%) y a fluorquinolonas (n=38; 74,5%). No existen casos de resistencia a imipenem o meropenem. Las resistencias antibióticas aparece en la figura 1 y los principales datos recogidos se muestran en la tabla 1.
Entre los pacientes que presentaron exitus a los 30 días, el 70,6% (n=12) fueron varones, la edad media fue de 67,7 años y la bacteria responsable fue E. coli en un 88,2% (n=15). Respecto a las comorbilidades entre los exitus a 30 días, la más habitual fue el cáncer (n=8; 47,1%), seguida de diabetes mellitus (n=7; 41,2%). El 58,8% (n=10) habían estado ingresados en centros hospitalarios en los 6 meses previos. La resistencia antibiótica más frecuente dentro de los exitus fue a aztreonam (n=17; 100%), amoxicilina/clavulánico (n=15; 88,2%), piperacilina/tazobactam (n=14; 82,4%) y fluorquinolonas (n=12; 70,6%) y el 35,3% (n=6) recibió un tratamiento antibiótico empírico inadecuado. Los datos en función de la supervivencia a 30 días se hallan en la tabla 1.
El análisis univariante mostró que el paciente pluripatológico (OR: 5,018; IC95%: 1,414-17,811; p=0,016) y la bacteriemia de foco desconocido (OR=6,667; IC95%: 1,137-39,098; p=0,034) fueron factores de riesgo asociados a mortalidad. En cambio, el foco urinario se relaciona significativamente con mejor pronóstico (OR 0,169; IC95%: 0,041-0,699; p=0,021). Los resultados se muestran en la tabla 2.
Al realizar el análisis multivariante, se encontró que el paciente pluripatológico (OR: 4,818; IC95% 1,376-16,869; p=0,014), la intervención quirúrgica en el mes previo (OR: 0,114; IC95%: 0,014-0,898; p=0,039) y la infección de origen urinario (OR: 0,191; IC95%: 0,055-0,664; p=0,009) son factores asociados independientemente a la mortalidad a 30 días. Los hallazgos se reflejan en la tabla 2.
DISCUSIÓN
En nuestro estudio, se evidencia como la presencia de pluripatología de base se asocia a mayor mortalidad en pacientes con bacteriemia producida por enterobacterias productoras de BLEE. Por el contrario, el foco urinario como origen de la bacteriemia y el antecedente de cirugía previa se asocian con una menor mortalidad en estos pacientes.
En nuestra serie, la bacteriemia producida por enterobacterias productoras de BLEE presenta una mortalidad del 33,3%. Estas cifras se corresponden con lo evidenciado en otros estudios, en los cuales se han comunicado cifras de mortalidad que oscilan entre el 15 y el 46% (8, 9, 14). Esta alta mortalidad refleja la importancia del adecuado conocimiento de los factores asociados a la presencia de estas infecciones así como de su adecuado manejo terapéutico.
Los resultados de nuestro estudio mostraron que el 70% de los pacientes pluripatológicos fallecieron, en contraste con el 32,4% de los pacientes que presentaba menor comorbilidad El aumento de la mortalidad en relación con la mayor presencia de patologías de base ha sido recogido ampliamente en la literatura (2, 5, 11, 15). Entre estas patologías se encuentran la diabetes mellitus, la enfermedad pulmonar obstructiva crónica, las neoplasias y la insuficiencia hepática, las cuales conllevan, además de un deterioro funcional de los pacientes, un cierto grado de inmunosupresión. Ello posibilita una peor respuesta ante situaciones producidas por la presencia de bacteriemia, como el shock o el fallo de órganos, determinando, por tanto, mayor mortalidad.
En nuestro trabajo, la infección de origen urinario se asocia a menor riesgo de mortalidad (OR 0,191), siendo concordante con los hallazgos de estudios como el de Hyle et al (16) y pudiendo explicarse por el menor compromiso directo de órganos vitales, a diferencia de lo que ocurre en las bacteriemias de origen pulmonar o abdominal.
El antecedente de intervención quirúrgica en el mes previo también se asocia a una menor mortalidad (OR 0,114) en nuestro estudio. Ello podría ser debido a que, en nuestro centro, la mayoría de pacientes que han sido sometidos a una intervención quirúrgica y que presentan síntomas de una posible infección reciben tratamiento empírico con carbapenemas, los cuales constituyen el tratamiento antibiótico de elección de estas infecciones.
En nuestro trabajo, el 33,7% de las bacteriemias por enterobacterias productoras de BLEE son de origen comunitario. En España ha ido aumentando la aparición de enterobacterias productoras de BLEE adquiridas en la comunidad, como se refleja en el estudio multicéntrico español de Díaz et al (5), donde ya se describía que el 31,5% del total de infecciones por E. coli productora de BLEE son casos puramente comunitarios.
En nuestro estudio, la resistencia antibiótica fue de: 90,2% para amoxicilina/clavulánico; 80,4% para piperacilina/tazobactam, 74,5% para fluorquinolonas, 58,8% para cotrimoxazol y 23,5% para aminoglucósidos, sin que se encontraran cepas resistentes a carbapenemas, pudiendo estar en relación con la necesidad de justificación para su empleo y la aplicación de políticas de desescalamiento. El alto porcentaje de resistencias a fluorquinolonas se apoya en lo objetivado en otros trabajos al estar mediadas por un plásmido que puede conferir ambos tipos de resistencia. (6, 16).
El 51% de las bacteriemias se trató con antimicrobianos inapropiados, datos similares a los hallados por Rodríguez-Baño et al en un trabajo multicéntrico español (9). Hyle et al (17) ya demostró que el tratamiento antimicrobiano empírico inadecuado se relaciona con mayor mortalidad en las bacteriemias de origen no urinario. Sin embargo, nuestro estudio no reflejó diferencias estadísticamente significativas en la variable de mortalidad a 30 días, posiblemente debido al pequeño tamaño de la serie y al alto porcentaje de bacteriemias de origen urinario.
Nuestro estudio presenta las limitaciones inherentes a los estudios retrospectivos. Además el hecho de tratarse de un estudio unicéntrico dificulta la extrapolación de nuestros resultados a pacientes atendidos en otros centros. Por tanto, para confirmar nuestros resultados sería necesaria la realización de estudios prospectivos y multicéntricos.
En conclusión, la bacteriemia por enterobacterias productoras de BLEE se asocia a una alta mortalidad, siendo los pacientes de mayor riesgo aquellos que presentan mayor número de patologías de base. Por el contrario, la bacteriemia procedente de foco urinario y los pacientes quirúrgicos se asocian con menor mortalidad.
1González-Gasca, FJ; 1Castón-Osorio, JJ; 1Porras-Leal, L; 1Ros-Izquierdo, J; 1Portillo J; 2Martínez, J; 2Romero MD; 1dela Rocha-Vedia, I; 1Clemente-Tomé, I; 1Monroy, C; 1Gijón, JA
Tablas y figuras:
| Tabla 1 Distribución de las características de los pacientes con bacteriemia por enterobacteria productora de BLEE global y en relación a la supervivencia. | ||||
| Variable | Exitus
n=17 (33,33%) |
No exitus
n= 34 (66,67%) |
Total
n=51 (%) |
Pa |
| Edad (media±DE) | 67,71±14,23 | 71,74±13,71 | 70,39±13,94 | 0,419 |
| Sexo (varón/mujer) | 12/5 | 20/14 | 32/29 | 0,413 |
| Enterobacteria | 0,647 | |||
| Escherichia coli | 15 (88,2%) | 28 (82,4%) | 43 (84,3%) | 0,703 |
| Klebsiella pneumoniae | 1 (5,9%) | 5 (14,7%) | 6 (11,7%) | 0,650 |
| Enterobacter aerogenes | 1 (5,9%) | 0 (0%) | 1 (2,0%) | 0,333 |
| Enterobacter cloacae | 0 (0%) | 1 (2,9%) | 1 (2,0%) | 1 |
| Bacteriemia polimicrobiana | 1 (5,9%) | 6 (17,6%) | 7 (13,7%) | 0,401 |
| Comorbilidad | ||||
| Pluripatológico | 12 (70,6) | 11 (32,4%) | 23 (45,1%) | 0,010 |
| Diabetes mellitus | 7 (41,2%) | 9 (26,5%) | 16 (31,4%) | 0,286 |
| Broncopatía crónica | 6 (35,3%) | 10 (29,4%) | 16 (31,4%) | 0,670 |
| Insuficiencia cardiaca | 6 (35,3%) | 4 (11,8%) | 10 (19,6%) | 0,065 |
| Cardiopatía isquémica | 5 (29,4%) | 6 (17,6%) | 11 (21,6%) | 0,472 |
| Hepatopatía crónica | 5 (29,4%) | 7 (20,6%) | 12 (23,5%) | 0,503 |
| Neoplasia | 8 (47,1%) | 14 (41,2%) | 22 (43,1%) | 0,546 |
| Enfermedad renal crónica | 3 (17,6%) | 13 (38,2%) | 16 (31,4%) | 0,135 |
| Hemodiálisis | 1 (5,9%) | 2 (5,9%) | 3 (5,9%) | 1 |
| Cirugía en los 30 días previos | 2 (11,8%) | 10 (29,4%) | 12 (23,5%) | 0,293 |
| Estancia hospitalaria previa | 10 (58,8%) | 18 (52,9%) | 28 (54,9%) | 0,691 |
| Días de estancia hospitalaria previa (media±DE) | 8,81±18,465 | 10,19±23,208 | 9,73±21,552 | 0,825 |
| Antibioterapia previa | 10 (58,8%) | 20 (58,8%) | 30 (58,8%) | 1 |
| Betalactámico | 4 (23,5%) | 11 (33,3%) | 15 (30,0%) | 0,474 |
| Cefalosporina | 3 (17,6%) | 6 (18,2%) | 9 (18,0%) | 0,963 |
| Fluorquinolonas | 3 (17,6%) | 8 (24,2%) | 11 (22,0%) | 0,728 |
| Carbapenemas | 3 (17,6%) | 3 (9,1%) | 6 (12%) | 0,396 |
| Lugar de adquisición de bacteriemia | 0,814 | |||
| Comunitaria | 6 (35,3%) | 13 (38,2%) | 19 (37,3) | 0,838 |
| Asociada a cuidados sanitarios y nosocomial | 11 (62,7%) | 21 (61,8%) | 32 (62,7) | 0,838 |
| Estancia en Unidad de Cuidados Intensivos | 2 (11,8%) | 4 (11,8%) | 6 (11,8%) | 1 |
| Procedimientos invasivos previo bacteriemia | ||||
| Ventilación mecánica | 2 (11,8%) | 4 (11,8%) | 6 (11,8%) | 1 |
| Sonda vesical | 3 (17,6%) | 7 (20,6%) | 10 (19,6%) | 1 |
| Días de sonda vesical (media±DE) | 7,03±20,302 | 2,06±7,018 | 3,88±13,32 | 0,224 |
| Sonda nasogástrica | 4 (23,5%) | 4 (11,8%) | 8 (15,7%) | 0,416 |
| Días de sonda nasogástrica (media±DE) | 3,31±8,799 | 2,15± 8,697 | 2,53±8,656 | 0,667 |
| Catéter central | 5 (29,4%) | 4 (11,8%) | 9 (17,6%) | 0,140 |
| Días de catéter central (media±DE) | 1,57±4,071 | 1,12±3,616 | 1,25±3,716 | 0,721 |
| Nutrición parenteral | 2 (11,8%) | 0 (0%) | 2 (3,9%) | 0,107 |
| Esteroides | 6 (35,3%) | 9 (26,5%) | 15 (29,4%) | 0,514 |
| Foco de origen de bacteriemia | 0,004 | |||
| Neumonía nosocomial | 0 (0%) | 1 (2,9%) | 1 (2,0%) | 1 |
| Neumonía asociada a ventilador | 0 (0%) | 1 (2,9%) | 1 (2,0%) | 1 |
| Urinario | 3 (17,6%) | 19 (55,9%) | 22 (43,1) | 0,009 |
| Catéter central | 2 (11,8%) | 0 (0%) | 2 (3,9%) | 0,107 |
| Herida quirúrgica | 3 (17,6%) | 4 (11,8%) | 7 (13,7%) | 0,673 |
| Abdominal | 4 (23,5%) | 7 (20,6%) | 11 (21,6%) | 1 |
| Desconocida | 5 (29,4%) | 2 (5,9%) | 7 (13,7%) | 0,034 |
| Antibioterapia empírica inapropiada | 6 (35,3%) | 20 (58,8%) | 26 (51,0%) | 0,113 |
| Shock séptico | 5 (29,4%) | 7 (20,6%) | 12 (23,5%) | 0,503 |
| Índice de Pitt (media±DE) | 2,59±3,355 | 2,09±2,864 | 2,25±3,012 | 0,581 |
| Resistencia antimicrobiana | ||||
| Fluorquinolonas | 12 (70,6%) | 26 (76,5%) | 38 (74,5%) | 0,738 |
| Aminoglucósidos | 3 (17,6%) | 9 (26,5%) | 12 (23,5%) | 0,728 |
| Aztreonam | 17 (100%) | 33 (97,1%) | 50 (98,0%) | 1 |
| Amoxicilina/clavulánico | 15 (88,2%) | 31 (91,2%) | 46 (90,2%) | 1 |
| Piperacilina/tazobactam | 14 (82,4%) | 27 (79,4%) | 41 (80,4%) | 1 |
| Carbapenem | 0 (0%) | 0 (0%) | 0 (0%) | – |
| Cotrimoxazol | 9 (52,9%) | 21 (61,8%) | 30 (58,8%) | 0,546 |
| DE, desviación estándar. a P para Χ2, estadístico exacto de Fisher, U Mann-Whitney y t de Student, según corresponda | ||||
| Tabla 2: Análisis Univariante | |||
| Variable | OR | IC95% OR | P |
| Pluripatológico | 5,018 | 1,414-17,811 | 0,016 |
| Infección tracto Urinario | 0,169 | 0,041-0,699 | 0,021 |
| Infección de origen desconocido | 6,667 | 1,137-39,098 | 0,034 |
| Análisis multivariante | |||
| Variable | OR | IC95% OR | P |
| Pluripatológico | 4,818 | 1,376-16,869 | 0,014 |
| Cirugía 30 días previos | 0,114 | 0,014-0,898 | 0,039 |
| Foco Urinario | 0,191 | 0,055-0,664 | 0,009 |
| Sólo si p< 0,05. Variable dependiente: Exitus a 30 días | |||
BIBLIOGRAFÍA
1. Donnemberg M. Enterobacteriaceae. En: Mandell GL, Bennet JE, Dolin R, editors. Principles and practice on infectious diseases. 6a ed. Pensilvania: Elsevier. 2005; 2567-86.
2. Carratalà J, Mykietiuk A, Fernández-Sabé N, Suárez C, Dorca J, Verdaguer R, Manresa F, Gudiol F. Health care-associated pneumonia requiring hospital admission: epidemiology, antibiotic therapy, and clinical outcomes. Arch Intern Med. 2007;167:1393-9.
3. Arias CA, Murray BE. Antibiotic-resistant bugs in 21st century: a clinical super-challenge. N Engl J Med. 2009; 360:439-43.
4. Oteo J, Navarro C, Cercenado E, Delgado-Iribarren A, Wilhelmi I, Orden B, García C, Miguelañez S et al. Spread of Escherichia coli strains with high-level cefotaxime and ceftazidime resistance between the community, long-term care facilities, and hospital institutions. J Clin Microbiol. 2006; 44: 2359-66.
5. Angel Díaz M, Ramón Hernández J, Martínez-Martínez L, Rodríguez-Baño J, Pascual A; Grupo de Estudio de Infección Hospitalaria (GEIH). Escherichia coli y Klebsiella pneumoniae productoras de betalactamasas de espectro extendido en hospitales españoles: segundo estudio multicéntrico (proyecto GEIH-BLEE2006) Enferm Infecc Microbiol Clin. 2009; 27(9):503–510
6. European Centre for Disease Control and Prevention (ECDC). European Antimicrobial Resistance Surveillance System (EARSS) Annual Report 2007.
7. Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC). Estudio Nacional de Vigilancia de Infección Nosocomial en Servicios de Medicina Intensiva (ENVIN-HELICS): Informe 2008.
8. Einhorn AE, Neuhauser MM, Bearden DT, Quinn JP, Pendland SL. Extended-Spectrum Beta-Lactamases: Frequency, Risk Factors, and Outcomes. Pharmacotherapy. 2002 ;22
9. Rodríguez-Baño J, Picón E, Gijón P, Hernández JR, Cisneros JM, Peña C, Almela M, Almirante B, et al. Risk Factors and Prognosis of Nosocomial Bloodstream Infections Caused by Extended-Spectrum-Beta Lactamase-Producing Escherichia coli. J Clin Microbiol. 2010;48(5):1726-31.
10. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36(5):309-32.
11. Chow JW, Fine MJ, Shlaes DM, Quinn JP, Hooper DC, Johnson MP, Ramphal R, Wagener MM, et al. Enterobacter bacteremia: clinical features and emergence of antibiotic resistance during therapy. Ann Intern Med. 1991;115.
12. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections. Am J Infect Control 1988; 16:128-140.
13. Horan TC, Gaynes RP, Martone WJ, Jarvis WR, Emori TG. CDC definitions of nosocomial surgical site infections, 1992; A modification of CDC definitions of surgical wound infections. Infection Control Hosp Epidemiol. 1992; 13 606-608.
14. Cisneros-Herreros JM, Cobo-Reinoso J, Pujol-Rojo M, Rodríguez-Baño, J, Salavert-Lletí. M. Guía para el diagnóstico y tratamiento del paciente con bacteriemia. Guías de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Enferm Infecc Microbiol Clin. 2007;25:111-30.
15. Gaynes R, Edwards JR. Overview of nosocomial infections caused by gram-negative bacilli. Clin Infect Dis. 2005;41:848-54.
16. Stürenburg E, Mack D. Extended-spectrum ß-lactamases: implications for the clinical microbiology laboratory, therapy, and infection control. J Infect 2003; 47: 273-95.
17. Hyle EP, Lipworth AD, Zaoutis TE, Nachamkin I, Bilker WB, Lautenbach E. Impact of Inadequate Initial Antimicrobial Therapy on Mortality in Infections Due to Extended-Spectrum Beta-Lactamase–Producing Enterobacteriaceae: Variability by Site of Infection. Arch Intern Med. 2005;165:1375-1380.














Palabras Clave: Bacteriemia, Betalactamasas de espectro extendido, Enterobacteria, Escherichia coli, Mortalidad, Tratamiento inadecuado