Superioridad del índice de puntuación de movimiento parietal sobre la fracción de eyección del ventrículo izquierdo en la predicción de eventos cardiovasculares tras un infarto agudo de miocardio
.
Alfonso Jurado-Román.
DIRECTORES: Profesor Carlos Sáenz de la Calzada y Rocío Tello de Meneses.
PROCEDENCIA: Hospital General Universitario de Ciudad Real. Servicio de Cardiología. Unidad de Hemodinámica y cardiología intervencionista
AUTOR PARA CORRRESPONDENCIA:
Alfonso Jurado-Román.
Hospital General Universitario de Ciudad Real. Servicio de Cardiología. Unidad de Hemodinámica y cardiología intervencionista.
e-mail: alfonsojuradoroman@gmail.com
INTRODUCCIÓN
La importancia pronóstica de la función sistólica del ventrículo izquierdo después de un infarto agudo de miocardio (IAM) ha sido establecida ampliamente en la literatura científica1-14. Estos estudios han usado la fracción de eyección (FEVI) para seleccionar a los pacientes que se beneficiaban de recibir determinadas terapias. Sin embargo, se ha demostrado que la FEVI puede ser casi normal en pacientes con hipercinesia regional compensatoria a pesar de tener daño miocárdico extenso15-19. Además, los IAM inferiores pueden asociarse a una disminución menor de la FEVI que infartos de tamaño similar en la cara anterior20. Así, en algunos pacientes, la FEVI puede ser un indicador impreciso del grado de daño miocárdico y esto podría afectar a su valor pronóstico. El índice de puntuación del movimiento parietal (IPMP) constituye una alternativa sencilla a la FEVI14,21 para cuantificar la función sistólica después de un IAM10, 17, 22. Consiste en un sistema de puntuación basado en la contractilidad de los segmentos individuales en el que las puntuaciones más altas indican una alteración más grave del movimiento de la pared23. La diferencia fundamental con la FEVI, es que el IPMP puntúa igual la hipercinesia que la normocinesia, evitando la compensación que los segmentos hipercontráctiles realizan sobre los disfuncionantes en la medida de la FEVI, valorando así más directamente el daño de los últimos. Algunos estudios han comparado la capacidad de ambas medidas para predecir eventos tras un IAM, sin embargo, realizaban las mediciones en la fase hiperaguda24-26, momento en el que la hipercinesia compensadora es máxima y podría suponer un sesgo, que debería reducirse con el paso del tiempo, a medida que los segmentos hipercontráctiles recuperan su función normal. Nuestro objetivo fue comparar el valor pronóstico del IPMP y de la FEVI tras un IAM más allá de la fase hiperaguda.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional prospectivo en el que se incluyeron 352 pacientes con el diagnóstico inicial de IAM27. Dos ecocardiografistas expertos independientes analizaron los ecocardiogramas realizados más allá de las primeras 48 horas del ingreso y antes del alta. La FEVI fue calculada mediante el método de Simpson biplano y el IPMP mediante el modelo de 17 segmentos. La contractilidad de los segmentos individuales se puntuó a través de la siguiente clasificación semicuantitativa: 1=normal o hipercontráctil; 2=hipocinesia; 3=acinesia; 4=discinesia. Se calculó el IPMP mediante la división de la suma de las puntuaciones de movimiento de la pared entre el número de segmentos visualizados. Utilizamos como punto de corte de severidad un IPMP>1,8 basándonos en estudios que han correlacionado esta cifra con una FEVI<40%. Se realizaron revisiones clínicas a los 6 meses del alta, al año, a los dos años y al final del periodo de seguimiento. Se consideró como endpoint primario el compuesto de mortalidad por cualquier causa o reingreso por insuficiencia cardiaca (IC). Como endpoints secundarios se estudiaron de forma independiente los componentes del endpoint primario.
RESULTADOS Características de los pacientes El 76% eran varones con una edad media de 63,4 ± 13,6 años. La FEVI media fue de 52,2 ± 11,4% y el IPMP medio de 1,4 ± 0,4. El resto de características están descritas en la figura 1. En 180 pacientes (80,7%) el IPMP estaba elevado a pesar de tener una FEVI>40%, siendo >1,8 en 22 pacientes (9,9%) mientras que en ningún paciente la FEVI era <55% cuando el IPMP era normal.
Se observó una correlación lineal negativa fuerte entre el IPMP y la FEVI (r=-0,78; p<0,0001) que era algo mayor en los pacientes que ingresaron con un SCACEST y en los infartos que afectaban a la cara anterior (Figura 1). Predicción de eventos en la población global Durante una mediana de seguimiento de 30,5 meses (24,2-49,5), 41 pacientes (14,7%) presentaron el endpoint primario, 30 (10,9%) fallecieron y 17 (6,1%) fueron hospitalizados por IC. Se realizó un análisis de supervivencia mediante regresión de Cox hacia delante. En este análisis, un IPMP >1,8 fue el predictor más potente del combinado de muerte o reingreso por IC. También fueron predictores independientes la edad y la FEVI. Se observó una tendencia hacia la reducción de eventos en los pacientes con revascularización completa (RC) (Tabla 1).
Un IPMP>1,8 fue a su vez el predictor más potente de mortalidad. También fueron predictores independientes la RC, la edad y una FEVI<40% (Tabla 1). Un IPMP >1,8 fue el predictor más importante de reingreso por IC. La edad fue otro predictor independiente mientras que la FEVI no lo fue (Tabla 1).
Predicción de eventos en subgrupos especiales
Se analizaron subgrupos de infartos con menor daño miocárdico (SCASEST, FEVI>40%, sin afectación de la cara anterior y con creatin-kinasa (CK) normal. En todos estos subgrupos, tanto el IPMP como la FEVI fueron predictores de eventos adversos en el análisis univariante, si bien, sólo el IPMP lo fue en el multivariante, siendo el predictor más potente. Un IPMP>1,8 multiplicaba la tasa de eventos x 5 y reducía su tiempo libre de eventos a la mitad.
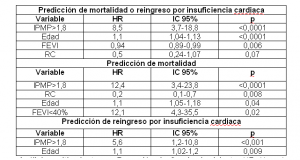
Tabla 1. Predictores de mortalidad o reingreso por insuficiencia cardiaca.
Análisis multivariante por Regresión de Cox hacia delante. HR: Hazard ratio; IC 95%: intervalo de confianza del 95%; IPMP: índice de puntuación de movimiento parietal; FEVI: fracción de eyección del ventrículo izquierdo; RC: revascularización completa
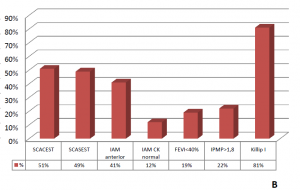
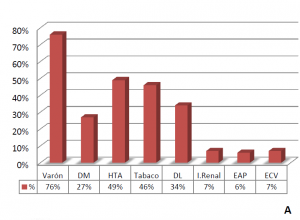
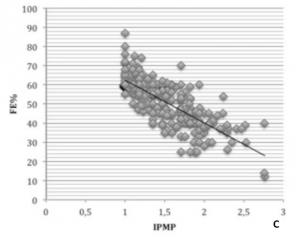
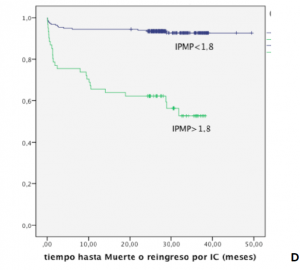
A-B: Características basales de los pacientes. C: Correlación lineal entre FEVI e IPMP. D: Curva de supervivencia de Kaplan Meier para predicción de mortalidad o reingreso por insuficiencia cardiaca en función del IPMP. DM: diabetes mellitus; HTA: Hipertensión arterial; DL: dislipemia; I Renal: insuficiencia renal; EAP: enfermedad arterial periférica; ECV: enfermedad cerebrovascular; SCACEST: Síndrome coronario agudo con elevación del segmento ST; SCASEST: Síndrome coronario agudo con elevación del segmento ST; IAM: infarto agudo de miocardio; CK: Creatin-fosfo-kinasa; FEVI: fracción de eyección del ventrículo izquierdo; IPMP: índice de puntuación de movimiento parietal; FE: fracción de eyección. IC: Insuficiencia cardiaca.
CONCLUSIONES
El IPMP es una técnica ecocardiográfica sencilla, reproducible y aplicable en la práctica clínica. Tras la fase hiperaguda de un primer IAM, el IPMP y la FEVI presentan una fuerte correlación lineal negativa, mayor en pacientes con mayor daño miocárdico. Tanto la FEVI como el IPMP aportan una importante información pronóstica después de un primer IAM. Sin embargo, valorados más allá de la fase hiperaguda, el IPMP es un predictor pronóstico más potente, especialmente en infartos con menor daño miocárdico.
BIBLIOGRAFÍA
1. St John Sutton M, Pfeffer MA, Plappert T, Rouleau JL, Moye LA, Dagenais GR, et al. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation. 1994;89:68-75
2. Volpi A, De Vita C, Franzosi MG, Geraci E, Maggioni AP, Mauri F et al. Determinants of 6-month mortality in survivors of myocardial infarction after thrombolysis. Results of the gissi-2 data base. The ad hoc working group of the gruppo italiano per lo studio della sopravvivenza nell’infarto miocardico (gissi)-2 data base. Circulation. 1993;88:416-429
3. Pfeffer MA, Braunwald E, Moye LA, Basta L, Brown EJ, Jr., Cuddy TE et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The save investigators. N Engl J Med. 1992;327:669-677
4. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B et al. Eplerenone Post-Acute Myocardial Infarction Heart Failure E, Survival Study I. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348:1309-1321
5. The Multicenter postinfarction Research Group. Risk stratification and survival after myocardial infarction. N Engl J Med. 1983;309:331-336.
6. Heger JJ, Weyman AE, Wann LS, Rogers EW, Dillon JC, Feigenbaum H. Cross-sectional echocardiographic analysis of the extent of left ventricular asynergy in acute myocardial infarction. Circulation. 1980;61:1113-1118
7. Kan G, Visser CA, Koolen JJ, Dunning AJ. Short and long term predictive value of admission wall motion score in acute myocardial infarction. A cross sectional echocardiographic study of 345 patients. Br Heart J. 1986;56:422-427
8. The SOLVD investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med. 1991;325:293-302.
9. Waldo AL, Camm AJ, deRuyter H, Freidman PL, MacNeil DJ, Pitt B et al. Survival with oral d-sotalol in patients with left ventricular dysfunction after myocardial infarction: Rationale, design, and methods (the sword trial). Am J Cardiol. 1995;75:1023-1027
10. Berning J, Steensgaard-Hansen F. Early estimation of risk by echocardiographic determination of wall motion index in an unselected population with acute myocardial infarction. Am J Cardiol. 1990;65:567-576
11. Kelly MJ, Thompson PL, Quinlan MF. Prognostic significance of left ventricular ejection fraction after acute myocardial infarction. A bedside radionuclide study. Br Heart J. 1985;53:16-24
12. Ong L, Green S, Reiser P, Morrison J. Early prediction of mortality in patients with acute myocardial infarction: A prospective study of clinical and radionuclide risk factors. Am J Cardiol. 1986;57:33-38
13. Dwyer EM, Jr., Greenberg HM, Steinberg G. Clinical characteristics and natural history of survivors of pulmonary congestion during acute myocardial infarction. The multicenter postinfarction research group. Am J Cardiol. 1989;63:1423-1428
14. Kober L, Torp-Pedersen C, Carlsen JE, Bagger H, Eliasen P, Lyngborg K et al. A clinical trial of the angiotensin-converting-enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. Trandolapril cardiac evaluation (trace) study group. N Engl J Med. 1995;333:1670-1676
15. Urena PE, Lamas GA, Mitchell G, Flaker GC, Smith SC, Jr., Wackers FJ, et al. Ejection fraction by radionuclide ventriculography and contrast left ventriculogram. A tale of two techniques. Save investigators. Survival and ventricular enlargement. J Am Coll Cardiol. 1999;33:180-185
16. Rashid H, Exner DV, Mirsky I, Cooper HA, Waclawiw MA, Domanski MJ. Comparison of echocardiography and radionuclide angiography as predictors of mortality in patients with left ventricular dysfunction (studies of left ventricular dysfunction). Am J Cardiol. 1999;84:299-303
17. Jensen-Urstad K, Bouvier F, Hojer J, Ruiz H, Hulting J, Samad B et al. Comparison of different echocardiographic methods with radionuclide imaging for measuring left ventricular ejection fraction during acute myocardial infarction treated by thrombolytic therapy. Am J Cardiol. 1998;81:538-544
18. Ray SG, Metcalfe MJ, Oldroyd KG, Pye M, Martin W, Christie J et al. Do radionuclide and echocardiographic techniques give a universal cut off value for left ventricular ejection fraction that can be used to select patients for treatment with ace inhibitors after myocardial infarction? Br Heart J. 1995;73:466-469
19. Kjoller E, Kober L, Jorgensen S, Torp-Pedersen C. Long-term prognostic importance of hyperkinesia following acute myocardial infarction. Trace study group. Trandolapril cardiac evaluation. Am J Cardiol. 1999;83:655-659
20. McClements BM, Weyman AE, Newell JB, Picard MH. Echocardiographic determinants of left ventricular ejection fraction after acute myocardial infarction. Am Heart J. 2000;140:284-289
21. Dofetilide in patients with left ventricular dysfunction and either heart failure or acute myocardial infarction: Rationale, design, and patient characteristics of the diamond studies. Danish investigations of arrhythmia and mortality on dofetilide. Clin Cardiol. 1997;20:704-710
22. Senior R, Soman P, Khattar RS, Lahiri A. Improved endocardial visualization with second harmonic imaging compared with fundamental two-dimensional echocardiographic imaging. Am Heart J. 1999;138:163-168
23. Schiller NB, Shah PM, Crawford M, DeMaria A, Devereux R, Feigenbaum H et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American society of echocardiography committee on standards, subcommittee on quantitation of two-dimensional echocardiograms. J Am Soc Echocardiogr. 1989;2:358-367
24. Carluccio E, Tommasi S, Bentivoglio M, Buccolieri M, Prosciutti L, Corea L. Usefulness of the severity and extent of wall motion abnormalities as prognostic markers of an adverse outcome after a first myocardial infarction treated with thrombolytic therapy. The American journal of cardiology. 2000;85:411-415
25. G I W Galasko SB, A Lahiri, R Senior. A prospective comparison of echocardiographic wall motion score index and radionuclide ejection fraction in predicting outcome following acute myocardial infarction.Heart 2001;86:271-276
26. Moller JE, Hillis GS, Oh JK, Reeder GS, Gersh BJ, Pellikka PA. Wall motion score index and ejection fraction for risk stratification after acute myocardial infarction. Am Heart J. 2006;151:419-425
27. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, Writing Group of the Joint ESC/ACCF/AHA/WHF. Third universal definition of myocardial infarction. Eur Heart J. 2012;33:2551-2567













