ROMOSOZUMAB: UN FÁRMACO ESPERANZADOR EN LA OSTEOPOROSIS POSTMENOPAUSICA
Joaquín Castro Giménez,* Pedro Rozas Moreno,** Antonio Sáenz Gutiérrez,*** Constanza Muñoz Hornero.*
* S. Medicina Interna . Hospital General Universitario de Ciudad Real
** S. Endocrinología. Hospital General Universitario de Ciudad Real
*** S. Medicina Interna. Hospital Virgen de Altagracia. Manzanares (Ciudad Real).
AUTOR PARA CORRESPONDENCIA
Joaquín Castro Giménez
Hospital General Universitario de Ciudad Real. S. Medicina Interna.
Calle Rafael Torija s/n. CP 13.005
e-mail: j_castro@hotmail.it
McClung MR et al. Romosozumab in postmenopausal women with low bone mineral density. N Engl J Med. 2014 Jan 30;370(5): 412-20.
La osteoporosis se define como una pérdida de masa ósea junto con una alteración en su microestructura lo cual incrementa la fragilidad del hueso aumentando el riesgo de fractura1. Su prevalencia, morbimortalidad y costes sanitarios son elevados. En España, se calcula que dos millones de mujeres y alrededor de 800.000 hombres padecen osteoporosis2.
Desde la aparición de los primeros fármacos para el tratamiento de la osteoporosis los hallazgos se han centrado en fármacos que disminuyen la resorción ósea hasta que en 2002 con la aparición de la teriparatida3, PTH recombinante humana, se abrió un nuevo campo en los fármacos antiosteoporóticos con un tratamiento que conseguía, por primera vez, una ganancia neta de hueso clínicamente significativa.
En esta misma línea, la de los fármacos anabólicos, aparece el Romosozumab, un anticuerpo monoclonal que antagoniza a la esclerostina promoviendo la vía Wnt- betacatenina y con ello la ganancia de hueso4-5. El estudio más importante a este respecto es el que se ha publicado recientemente en The New England Journal of Medicine.
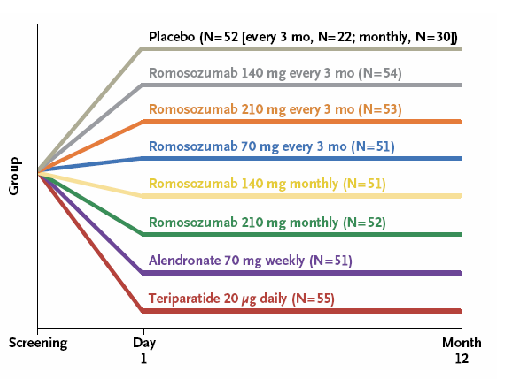
Se trata de un estudio fase 2, aleatorizado y controlado por placebo que se ha llevado a cabo en pacientes de múltiples países, entre ellos, España. Se randomizaron 419 pacientes postmenopáusicas en ocho grupos (Figura 1), cinco de ellos con Romosozumab a distintos regímenes, un grupo con alendronato 70 mg semanal, un grupo con teriparatida 20 μg diario y el grupo placebo. Todos los grupos tomaron al menos 1000 mg de calcio elemento y 800 UI de vitamina D diarios. El seguimiento a 12 meses mostró un incremento significativo tanto en el objetivo principal, ganancia de densidad mineral ósea (DMO) en columna lumbar, como en los secundarios, ganancia en otras localizaciones y marcadores de remodelado óseo.
Así, el aumento de DMO en columna lumbar en el grupo de Romosozumab con la posología más favorable (210 mg mensuales) fue de 11,3 %. Este incremento fue significativamente mayor que el observado con teriparatida (7,1 % p<0,001) así como alendronato (4,1% p<0,001) (Tabla 1). Otras localizaciones también presentaron mejoría significativa, a excepción, del tercio distal del radio que no presentó variaciones en relación con placebo.
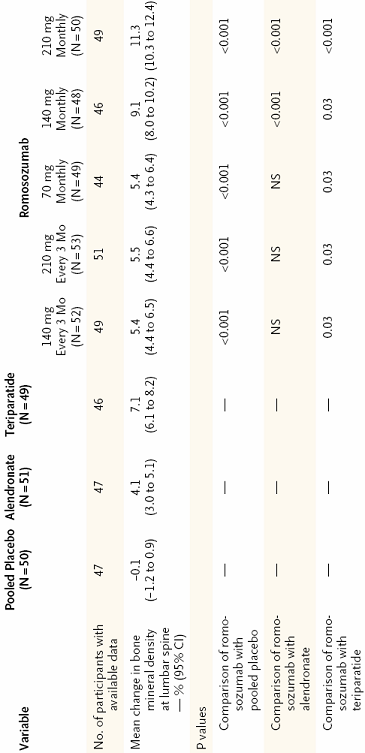
Tabla 1. Incremento en el porcentaje de densidad mineral ósea en columna lumbar en los ditintos grupos.
Los marcadores de remodelado óseo de formación sufrieron un aumento transitorio en sus valores, mientras que aquellos de resorción disminuyeron de manera consistente.
Los eventos adversos fueron equiparables al grupo de placebo salvo la irritación del punto de inyección que fue mayor en el grupo de Romosozumab, fue considerado un evento leve y que normalmente no supuso la discontinuación de la terapia. Otros eventos adversos de mayor gravedad como patología neoplásica o cardiológica se consideraron no relacionados con el propio tratamiento por parte del investigador.
En resumen, este estudio en fase 2 abre un nuevo campo en el tratamiento de la osteoporosis y siguientes estudios en fase 3, ya en desarrollo, arrojarán nuevos datos sobre este nuevo fármaco.
BIBLIOGRAFÍA
-
NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA. 2001;285(6):785-95.
-
Díaz Curiel M, García JJ, Carrasco JL, Honorato J, Pérez Cano R, Rapado A, et al. Prevalencia de osteoporosis determinada por densitometría en la población femenina española. Med Clin (Barc) 2001;116:86.
- Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001;344(19):1434-41.
- Saito-Diaz K, Chen TW, Wang X, Thorne CA, Wallace HA, Page-McCaw A, et al. The way Wnt works: Components and mechanism. Growth Factors. 2013;31(1):1-31.
- Alonso G, García-Martín A, Muñoz-Torres M. [Wnt pathway and sclerostin as new targets for assessment and treatment of osteoporosis]. Med Clin (Barc). 2012;139(14):634-9.














Palabras Clave: densidad osea, mujer, osteoporosis, Romosozumab