MARCADORES DE SEPSIS: SITUACIÓN ACTUAL
Aurora Muñoz Colmenero, Laura Rincón de Pablo, Patricia Nieto Sandoval Martín de la Sierra, Luis Sáenz Mateos, Elena Buces González, Vicente Morales Elipe.
Servicio de Análisis Clínicos.
Hospital General Universitario de Ciudad Real.
AUTOR PARA LA CORRESPONDENCIA
Aurora Úrsula Muñoz Colmenero,
Hospital General Universitario de Ciudad Real.
Servicio de Análisis Clínicos, Hospital
C/Obispo Rafael Torija, s/n 13005-Cuidad Real;
e-mail: : aurora_mc82@hotmail.com
PALABRAS CLAVE: SIRS, sepsis, proteína C reactiva, procalcitonina, citocinas.
RESUMEN:
Objetivos: Repasar el concepto de SIRS y sepsis, así como la importancia de un diagnóstico precoz de este último. Revisar los marcadores biológicos, disponibles y en fase de investigación, en el diagnóstico precoz y monitorización de la sepsis.
Estrategia de búsqueda: Búsqueda bibliográfica de datos en Pubmed y Elsevier –Doyma. Palabras clave utilizadas en la búsqueda, en castellano e inglés: SIRS, sepsis, proteína C reactiva, procalcitonina y citocinas.
Selección de estudios y datos: La selección de artículos se ha basado en la actualidad en función del tema y en la relación específica con los objetivos establecidos.
Síntesis de resultados: La sepsis se puede considerar como el SIRS secundario a una infección desencadenada por la entrada, en el torrente sanguíneo, de microorganismos o sus toxinas. Su incidencia, gravedad y mortalidad han aumentado en los últimos años. El diagnóstico precoz y la intervención terapéutica rápida y específica han demostrado ser cruciales. La sepsis puede ser difícil de distinguir de otros SIRS no infecciosos. La disponibilidad de marcadores biológicos de inflamación que añadan valor a la información clínica del paciente permitirá diferenciar mejor este proceso. Entre los marcadores clásicos de infección, la PCR y el recuento de leucocitos junto con su fórmula diferencial han sido los indicadores más usados, pero se necesitan marcadores de infección más sensibles y específicos. El marcador más utilizado en la actualidad es la PCT, aún así, sus valores deben interpretarse siempre dentro del contexto clínico del paciente. Existen otros marcadores pero se encuentran en fase de investigación.
Conclusiones: Existen situaciones en las que las manifestaciones clínicas y los parámetros analíticos actuales son insuficientes para establecer un diagnóstico de sepsis. Quizás, el uso conjunto de determinados biomarcadores ayude a la diferenciación de los cuadros clínicos.
OBJETIVOS
El principal objetivo es revisar la utilidad de los principales marcadores biológicos de sepsis, disponibles y emergentes, en el diagnóstico precoz y monitorización de la sepsis. Repasando, previamente, el concepto de SIRS y sepsis, además, de la importancia del diagnóstico precoz de este último.
ESTRATEGIA DE BÚSQUEDA
La búsqueda de artículos se ha realizado en las bases de datos bibliográficas Pubmed y Elsevier –Doyma, utilizando como palabras clave, en castellano e inglés: SIRS, sepsis, proteína C reactiva, procalcitonina y citocinas. La bibliografía consultada se ha centrado en artículos originales nacionales e internacionales y revisiones sistemáticas.
SELECCIÓN DE ESTUDIOS Y DATOS
Los estudios se han seleccionado atendiendo a la actualidad de los mismos en función del tema, a la relevancia científica y a los marcadores biológicos de sepsis utilizados.
SÍNTESIS DE RESULTADOS
El concepto de Síndrome de Respuesta Inflamatoria Sistémica (SIRS) se estableció por primera vez en la Conferencia de Consenso sobre Sepsis celebrada por la Society of Critical Care Medicine (SCCM) y el American College of Chest Physicians (ACCP) en 19921. Se definió como un síndrome generalizado caracterizado por la presencia de dos o más de los siguientes criterios, con independencia de su causa: a) Fiebre (temperatura central > 38ºC) o hipotermia (temperatura central < 36ºC). b) Taquicardia (> 90 latidos/minuto). c) Taquipnea (> 20 respiraciones/minuto), o hiperventilación (paCO2 < 32 mmHg) o necesidad de ventilación mecánica. d) Leucocitosis (> 12.000 leucocitos/mm3) o leucopenia (< 4.000 leucocitos/mm3) o recuento leucocitario con > 10% de formas inmaduras.
La sepsis se puede considerar como el SIRS secundario a una infección desencadenada por la entrada, en el torrente sanguíneo, de microorganismos o sus toxinas. La presencia de estas sustancias provoca una respuesta inflamatoria por parte del huésped con pérdida de la regulación de los mecanismos de defensa. Se desencadena la activación de los sistemas celulares que participan en la respuesta inmune (monocitos, macrófagos, neutrófilos, células endoteliales, plaquetas y linfocitos B y T), que da lugar a la secreción de mediadores de la inflamación, suscitando el control de la infección o su evolución a sepsis grave o shock séptico.
La sepsis es uno de los motivos de consulta más frecuentes en los servicios de urgencias pediátricas y una de las principales causa de mortalidad en la mayoría de unidades de cuidados intensivos no coronarias y neonatales. Además, uno de los grandes retos en pediatría y, en especial, en neonatología, es poder realizar un diagnóstico precoz que permita una supervivencia sin secuelas. Su incidencia se sitúa, aproximadamente, en un 2% de los ingresos hospitalarios, aumentando con la edad. La prevalencia de la sepsis grave entre los pacientes ingresados varía del 2% al 11% y la mortalidad del 28 al 50%2.
Su incidencia, gravedad y mortalidad han aumentado en los últimos años, a pesar de los avances en las técnicas de apoyo vital y la aparición de nuevos tratamientos. Esto ha sido debido, principalmente, a la mayor sensibilidad y especificidad diagnóstica de la enfermedad, al aumento de uso de técnicas invasivas que favorecen las infecciones, la edad de la población, enfermos inmunodeprimidos, microorganismos multirresistentes a los antibióticos convencionales y a las limitaciones para efectuar un diagnóstico precoz.
El diagnóstico precoz y la intervención terapéutica rápida y específica han demostrado ser cruciales en la recuperación de pacientes con sepsis. Cuando se logra iniciar un tratamiento antibiótico apropiado, la mortalidad se reduce al mínimo y la aparición de choque séptico e insuficiencia orgánica múltiple se reduce más de un 50%. Además, si el antibiótico se administra en las primeras 6 horas (h) del inicio del proceso infeccioso los datos mejoran significativamente. Sin embargo, en pacientes con signos clínicos de inflamación aguda, la sepsis puede ser difícil de distinguir de otras condiciones que producen SIRS no infeccioso. Por lo que, es útil contar con la información específica adicional para aumentar la exactitud del diagnóstico de sepsis en una etapa previa y así impedir la evolución de la enfermedad reduciendo la mortalidad, los costes sanitarios y el uso inadecuado de antibióticos que puede producir resistencias y toxicidad.
Por lo tanto, en el diagnóstico y monitorización de la sepsis hay que tener en cuenta tres aspectos fundamentales: manifestaciones clínicas, identificación microbiológica y marcadores biológicos.
Los primeros signos y síntomas de sepsis son generalmente muy inespecíficos, como fiebre y leucocitosis, complicando su diagnóstico. Por lo que muchas infecciones víricas y otras situaciones que cursan con fiebre, taquicardia, polipnea, leucocitosis y otros signos indicativos de infección, son tratadas empíricamente como infección bacteriana sin serlo.
Por otro lado, la identificación del agente etiológico no suele ser suficientemente rápida, ya que a veces no es posible conseguir muestras adecuadas del foco de la infección y las técnicas de aislamiento requieren un procesamiento y un tiempo de incubación. Además, no siempre se puede llegar a un diagnóstico etiológico ya que los hemocultivos negativos no excluyen la sepsis bacteriana dado que frecuentemente el paciente ha recibido tratamiento antibiótico previo y determinadas infecciones, como las neumonías, son bacteriémicas sólo en un bajo porcentaje.
La disponibilidad de nuevos marcadores biológicos de inflamación que añaden valor a la información clínica del paciente ha permitido diferenciar mejor este proceso. Esto ha conducido a una redefinición de los conceptos de SIRS y sepsis, en la Conferencia Internacional de Definición de Sepsis celebrada en 2001, en base a un nuevo sistema, sistema PIRO (Predisposition, Infection, Response, Organ dysfunction), que estratifica a los pacientes en función de la clínica y de los marcadores biológicos3.
Un marcador ideal de infección debería ser sensible y específico para permitir un diagnóstico precoz, controlar su evolución y su respuesta al tratamiento. Desafortunadamente, este marcador aún no existe.
Marcadores clásicos
La serie blanca está formada por los leucocitos, que se dividen en polimorfonucleares (neutrófilos, eosinófilos y basófilos) y mononucleares (linfocitos y monocitos). El sistema hematopoyético del organismo además de producir la cantidad de leucocitos necesaria para realizar las funciones fisiológicas, mantiene una reserva celular en la médula ósea que puede ser movilizada en la inflamación o en la infección, y su maduración se regula a través de los factores estimuladores de colonias y de las IL. Los neutrófilos son los leucocitos más abundantes en la sangre. Su función es fagocitar y destruir agentes patógenos a través de sustancias bactericidas. Son los leucocitos predominantes durante la primera fase de la respuesta inflamatoria y juegan un papel importante en la acumulación de otro tipo de leucocitos4.En la inflamación existe una migración de neutrófilos al foco inflamatorio produciéndose una alteración cualitativa y cuantitativa de estas células, aunque también es posible observar en una infección neutropenia con linfocitosis. Respecto a la alteración cualitativa de los neutrófilos es normal la presencia de células inmaduras en sangre periférica. La presencia de células inmaduras, y por tanto células de mayor tamaño, con células maduras en sangre periférica, unido a los avances tecnológicos de los analizadores de hematología, capaces de expresar el volumen de distribución neutrofílica ha hecho pensar a algunos investigadores en este parámetro como marcador de septicemia, ya que es independiente del número de neutrófilos. Presenta una sensibilidad del 69% y una especificidad del 100%, pero son necesarios más estudios para discernir una reacción leucemoide sin infección de una infección propiamente dicha4.
La velocidad de sedimentación globular es un marcador que se usaba como medida indirecta de las alteraciones en la concentración del fibrinógeno que influyen en la agregación eritrocitaria. Se eleva más lentamente que la PCR y puede tardar semanas en recuperar los valores iniciales. Puede dar lugar a resultados falsos positivos y falsos negativos cuando existe anemia, policitemia u otras alteraciones en la serie eritrocitaria.
Estos marcadores pueden ayudar en casos muy graves pero que no ofrecen la suficiente sensibilidad y especificidad, con posibilidad de una interpretación equivocada e imprecisa.
Proteína C reactiva
La PCR es una proteína plasmática no glicosilada, perteneciente a la familia de las pentatraxinas y formada por cinco subunidades idénticas, dispuestas por simetría pentamérica cíclica alrededor de un poro central y con un peso molecular de 118 kDa. En condiciones fisiológicas es una molécula muy estable, altamente resistente a la proteólisis.
Es un reactante de fase aguda clásico con síntesis principalmente hepática en respuesta al daño tisular o a la infección, previa estimulación de los hepatocitos por las citocinas, especialmente IL-1β, TNF-α, IL-6 e IL-8. También existe una síntesis en lesiones ateroscleróticas, riñón, neuronas y macrófagos alveolares. Su vida media en el plasma es de, aproximadamente, 19 h.
El ligando más característico de la PCR es la fosfocolina, interacción que es característica de la unión de esta proteína a múltiples microorganismos y que juega un papel importante en nuestra defensa frente a los mismos. Las células apoptóticas o necróticas poseen fosfocolina, la interacción con la PCR permite su opsonización y fagocitosis por los macrófagos, promoviendo una respuesta antiinflamatoria. Sin embargo, en situaciones en que existen células isquémicas, la PCR puede aumentar el daño tisular a través de la activación parcial del complemento, como ocurre en las células isquémicas tras un infarto de miocardio. Por esto, la PCR ejerce un papel defensivo o perjudicial, dependiendo de la situación de nuestros tejidos.
El elevado uso de la PCR como marcador inflamatorio se debe en parte, a sus características analíticas y preanalíticas:
– vida media relativamente larga.
– concentraciones no afectadas con el consumo de alimentos.
– no presenta patrones diurnos o variaciones estacionales, ni diferencias por cuestión de raza, sexo o edad.
– estabilidad en plasma durante la congelación.
– material estándar de la OMS para la calibración de nuevos ensayos.
– analizadores automáticos.
– métodos de alta sensibilidad.
El método de cuantificación de PCR, más frecuentemente empleado en la actualidad, es el ensayo inmunoturbidimétrico potenciado con partículas de látex. Estos métodos suelen tener un límite de cuantificación próximo a 0.5mg/dL (PCR convencional). Actualmente, existen otros métodos denominados PCR ultrasensible (hsPCR) para cuantificar por debajo de los límites de detección de la PCR convencional. Este método es útil para el estudio de estados inflamatorios crónicos de baja intensidad en individuos que por lo demás podrían ser considerados como normales y debe tener una capacidad de cuantificación por lo menos de 0.01mg/dL y suele considerarse elevada a partir de 0.3mg/dL.
La literatura relacionada con la capacidad de la PCR para discriminar la presencia o no de infección es contradictoria. La mayor parte de los estudios realizados refieren que se trata de un marcador con una especificidad limitada, ya que se han descrito concentraciones elevadas de PCR en pacientes no infectados. La especificad puede aumentar si se utilizan puntos de corte altos, o la población de estudio no tiene concentraciones elevadas de PCR a priori. Así, varios estudios realizados en pacientes no críticos indican que la PCR puede ser un marcador aceptable para diagnosticar sepsis o infecciones adquiridas en la comunidad, situando el punto de corte para el diagnóstico en estos pacientes en torno a 10 mg/dL con una especificidad del 88% y sensibilidad del 58% 6.
En pacientes críticos, la PCR se comporta como un marcador poco específico de infección, ya que la mayoría de estos pacientes tienen valores elevados7.
Otros estudios han evaluado la variación temporal para diagnosticar la infección, de forma que una elevación mayor o igual del 25% con respecto al día anterior en la concentración de PCR fue sugestiva de infección8. Pero, la cinética lenta, en su elevación tras la agresión y su disminución si la evolución es favorable, afecta de forma negativa a su capacidad pronóstica.
Procalcitonina
La PCT es una proteína de 116 aminoácidos, con un peso molecular de 13 KDa. Está constituida estructuralmente por una región aminoterminal de 57 aa (N-PCT), una región media, la calcitonina de 32 aa (CT), y una región carboxiterminal con 21 aa, la katacalcina o péptido-I carboxiterminal de CT (CCP-I). Por acción de la prohormona convertasa, la PCT se fragmenta en N-PCT y el conjugado CT- CCP-I que nuevamente por proteolisis se transforma en CT y CCP-I libre (Figura 1).
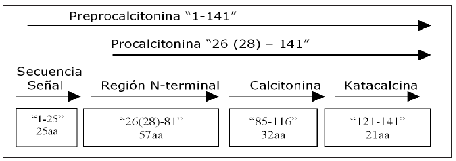
Figura 1. Representación esquemática de la preprocalcitonina, procalcitonina y sus fragmentos. aa=aminoácidos.
En condiciones normales, se sintetiza en las células C del tiroides. Sin embargo, en infecciones severas y sepsis es posible detectarla en sangre, los conocimientos actuales conducen a pensar que dicho incremento no es de origen tiroideo. Se cree que la procedencia de la PCT, en infecciones graves, es de células como los macrófagos y los monocitos especialmente de origen hepático y de células neurocrinas de pulmón e intestino. La producción de PCT parece ser inducida por el TNF-α y la IL-2. El principal estímulo para su liberación, dentro de la circulación sistémica en procesos infecciosos, es la presencia de endotoxinas bacterianas, exotoxinas y citoquinas proinflamatorias.
La cinética de elevación es muy rápida, detectándose en el suero a las 6-12h, tras un estímulo infeccioso. Alcanza su máxima concentración a las 12-16h, normalizándose tras la curación de la infección de manera inmediata. Los niveles permanecerán elevados mientras no se resuelva el proceso infeccioso. La PCT tiene una semivida de 24-30h y su vía de eliminación no ha sido establecida, aunque probablemente sea degradada por proteolisis, así sus concentraciones en sangre no se verán afectadas en la insuficiencia renal.
La PCT es una proteína muy estable. Su medición se puede realizar en suero o en plasma, a partir de sangre venosa o arterial y se puede medir por métodos cuantitativos o semicuantitativos (<0,5, 0,5-2,0, 2-10, ó >10 mg/L).
Numerosos estudios han demostrado que la concentración sérica de PCT aumenta principalmente en la inflamación sistémica grave de origen bacteriano y en las infecciones parasitarias cuando presentan una respuesta generalizada. Respecto a las infecciones fúngicas, los datos son controvertidos. Por el contrario, la concentración de PCT es baja cuando la infección es de origen vírico, está localizada, o no conduce a una respuesta inflamatoria sistémica.
Por otra parte, en situaciones críticas no asociadas a infección, como politraumatismos, quemaduras graves, pancreatitis, cirugía mayor, shock cardiogénico prolongado, enfermedades autoinmunes, neoplasias, etc., también pueden encontrarse concentraciones elevadas, aunque generalmente en menor cuantía.
Los recién nacidos, haya o no proceso infeccioso, presentan concentraciones fisiológicamente elevadas durante las primeras horas de vida, alcanzando un pico máximo entre las 18-30h. Su intervalo de referencia es distinto al de los adultos, hasta, aproximadamente, al segundo o tercer día del nacimiento.
Por lo tanto, la PCT no es un marcador de sepsis ideal porque puede elevarse en situaciones inflamatorias no infecciosas e incluso puede permanecer bajo en algunas infecciones. Aún así, ha sido propuesto como un marcador de gran utilidad en SIRS, infección y sepsis.
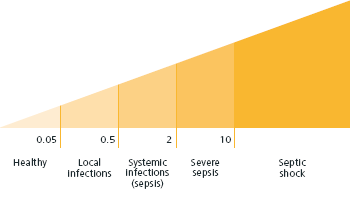
En general, concentraciones de PCT menores de 0,5 μg/L indican que la bacteriemia no es probable. Este valor puede darse en individuos sanos, procesos inflamatorios crónicos, enfermedades autoinmunes, infecciones virales e infecciones bacterianas localizadas de carácter leve a moderado. El rango entre 0,5 y 2 μg/L constituye lo que se podría denominar zona indeterminada o zona gris para el diagnóstico de proceso infeccioso con riesgo de consecuencias sistémicas. En pacientes con moderado riesgo de progresión a infección severa en SIRS, quemados, primeros tres días después de un trauma múltiple, intervención quirúrgica mayor, neonatos con menos de 48h de vida, medicamentos que estimulen la liberación de citoquinas proinflamatorias. Concentraciones por encima de 2 μg/L identifican pacientes con alto riesgo de progresión a una sepsis severa. Concentraciones plasmáticas de PCT mayores de 10 μg/L cuando existe una alta probabilidad de una sepsis severa o choque séptico (Figura 2).
En los casos de concentraciones falsamente elevados con ausencia de infección, los niveles estarán entre 1-10 μg/L y descenderán rápidamente por debajo de 1 μg/L en 48h. Concentraciones persistentemente altas orientan hacia la presencia de complicaciones, principalmente infecciones bacterianas. Al contrario, concentraciones falsamente bajas se encuentran sobre todo en el curso temprano de la infección. En estas circunstancias, si se detectan incrementos graduales entre las 6-24h siguientes, cabe sospechar una infección bacteriana subyacente. Todos estos cambios subrayan la gran importancia de las determinaciones seriadas de la PCT9.
El nivel de elevación de la PCT es dependiente de la gravedad del cuadro clínico, es decir, las concentraciones aumentan en proporción a la gravedad de la sepsis. En consecuencia, puede ayudar a identificar aquellos pacientes con alto riesgo de presentar shock séptico. Además, concentraciones altas, mantenidas o con tendencia a aumentar, pueden ser predictoras de mortalidad10 y, generalmente, señalan que la infección no se resuelve, no está bajo control y/o las medidas terapéuticas no son efectivas. En sentido contrario, el retorno a niveles basales indica que el proceso infeccioso se está resolviendo y que el tratamiento es efectivo.
La importancia de la PCT como marcador en el diagnóstico diferencial también ha sido demostrada en diversas infecciones como meningitis bacteriana vs vírica, endocarditis infecciosa, pancreatitis aguda complicada vs no complicada e infecciones del tracto urinario superior vs inferior
Marcadores emergentes
Más de 80 marcadores biológicos de sepsis han sido investigados tanto por sus capacidades de diagnóstico como de pronóstico. Sin embargo, las dificultades en su disponibilidad, el tiempo para obtener los resultados o la carencia de una estandarización clara, han limitado su uso en la práctica clínica diaria. Algunos de ellos aún se encuentran en investigación y parecen ser prometedores para el futuro próximo.
IL-6
Esta citoquina puede ser sintetizada por la mayoría de las células nucleadas aunque su fuente más importante son las células del sistema inmune: linfocitos T y B, monocitos y macrófagos. Estimula la síntesis hepática de proteínas de fase aguda, en respuesta a inflamación. Su liberación es muy rápida, detectándose concentraciones elevadas en circulación sistémica en las primeras 2h tras el estímulo inductor. Se aclara rápidamente, a las 24-48h del inicio de la infección sus niveles disminuyen hasta ser indetectables.
Ha demostrado buena sensibilidad en múltiples estudios acotados a la infección bacteriana y sepsis. Durante el periodo postoperatorio, en el trauma quirúrgico su elevación está relacionada con el daño tisular11 y tras cirugía mayor oncológica se comporta como un indicador temprano de sepsis12. Existen varios estudios con pacientes oncológicos con infección e inmunosuprimidos, pacientes febriles, pacientes con pancreatitis séptica y pacientes con sepsis grave, en los que se observa niveles altos de forma temprana que disminuyen rápidamente tras el tratamiento. Además, han encontrado niveles crecientes en estos pacientes a medida que se incrementa la gravedad del cuadro clínico13.
Muchos autores proponen a la IL-6 como marcador pronóstico predictor de mortalidad en pacientes sépticos, críticos, con neumonía o con shock séptico14. En estos últimos pacientes también ha demostrado ser un factor de riesgo de complicaciones, como el fallo renal agudo15.
Sin embargo, su secreción es inducida en enfermedades autoinmunes o cirugía mayor, siendo su principal problema la falta de especificidad.
Neopterina
La neopterina se había considerado como un simple catabolito terminal de la degradación de la GTP. Pero se la ha relacionado con la inhibición del metabolismo de los folatos en microorganismos patógenos intracelulares y la modulación de los receptores de interleuquina- 2 linfocitarios.
Esta molécula liberada por los macrófagos con la activación de la inmunidad celular en respuesta a infecciones por virus, protozoos y bacterias intracelulares, no se eleva en respuesta a infecciones causadas por bacterias extracelulares. Así, es útil, en la diferenciación de infecciones bacterianas y víricas. Es también un indicador de complicaciones inmunológicas en pacientes trasplantados.
La neopterina cuando se ha evaluado junto a la PCT como predictora de sepsis, disfunción orgánica múltiple y muerte en pacientes politraumatizados no se ha encontrado relación entre su elevación al segundo día del trauma y su capacidad para detectar los pacientes en sepsis o con riesgo de morir16. Sin embargo, existe un estudio en el que esta molécula se comporta como mejor factor pronóstico que la PCT en pacientes sépticos17.
TREM-1
El triggering receptor expressed on mieloide cells-1 (TREM-1) es un miembro de la superfamilia de las inmunoglobulinas, cuya expresión está aumentada en las células encargadas de la fagocitosis incrementando la respuesta inflamatoria en presencia de bacterias u hongos. Existe en dos formas: unida a la membrana y en forma soluble (sTREM-1), esta última ha sido detectada en el plasma de pacientes con sepsis, lavado broncoalveolar y condensado de espiración de pacientes con neumonía18,19.
Concentraciones de sTREM-1 de 5 ng/L o más en el lavado broncoalveolar pueden indicar neumonía asociada al ventilador19. Un estudio evaluó la capacidad de este marcador para distinguir pacientes con sepsis de otros con SIRS de causa no infecciosa, se encontró que el sTREM-1 tiene un valor de discriminación mayor comparado con la PCT y la PCR18. En líquido cefalorraquídeo, se ha observado que los niveles son significativamente más elevados en niños con meningitis bacteriana 20.
Presenta como inconveniente que no correlaciona con la gravedad. Además, existe aumento de los niveles de este marcador en otras patologías como las vasculitis, gastritis, pancreatitis y metástasis de tumores sólidos.
Adrenomedulina
La adrenomedulina (ADM), es un péptido con funciones autocrinas, endocrinas y parocrinas involucrado en la regulación endotelial de la presión sanguínea, protección contra el daño orgánico por sepsis o hipoxia y una potente actividad antimicrobiana a través de la modulación de la cascada del complemento. Se expresa en la glándula adrenal y en una gran variedad de tejidos. Se han detectado valores elevados en pacientes con insuficiencia cardíaca, algunos eventos del miocardio como infarto o cirugía, y en pacientes con cirrosis hepática. También se ha visto incrementada en pacientes con SIRS, sepsis y shock séptico, donde se correlaciona con los índices de gravedad y predicción de resultados21.
Un precursor de esta molécula es el pro-ADM que es más estable para las determinaciones de laboratorio. Hay autores que han demostrado que el pro-ADM tiene capacidad para diferenciar, en pacientes críticos, aquellos que presentan un proceso infeccioso, y además comportándose como marcador pronóstico22. Los mismos autores realizaron un estudio prospectivo observacional evaluando su seguridad para predecir la gravedad y evolución de las neumonías comunitarias, incluyó a 302 pacientes procedentes del servicio de urgencias por dicha patología. Los niveles fueron medidos en plasma, revelando un incremento en sus concentraciones con la gravedad de la enfermedad23.
Copeptina
Este biomarcador es un péptido estable cosintetizado por el organismo en conjunto con la vasopresina. Ha demostrado ser de gran utilidad debido a que se encuentra elevado en pacientes con sepsis, neumonía o bronquitis crónica reagudizada, y se asocia con un pronóstico desfavorable24. Incluso podría utilizarse como factor de riesgo para pacientes con infección del tracto respiratorio bajo25.
Algunos autores han demostrado que su elevación en pacientes con exacerbaciones agudas de la EPOC, es un factor de mal pronóstico26.
En un estudio con pacientes con shock séptico, se demostró que la pro-ADM y la copeptina cuando se obtienen niveles altos en la primera semana después del inicio del shock, se asocia significativamente con mortalidad. La capacidad predictiva mejoró cuando se combinaron ambos biomarcadores27.
No obstante, presenta como limitación, no reconocer enfermedad o diagnósticos diferenciales. Por ejemplo, sus valores también están elevados en pacientes con insuficiencia cardíaca. De hecho, permite descartar tempranamente un infarto agudo de miocardio en pacientes con dolor precordial mostrando un valor predictivo negativo del 99.7%28.
CONCLUSIONES
Existen situaciones en las que las manifestaciones clínicas y los parámetros analíticos actuales son insuficientes para establecer un diagnóstico de sepsis.
La PCR posee una elevada sensibilidad diagnóstica de inflamación, pero su baja especificidad limita su utilidad clínica como marcador de sepsis. Su concentración plasmática permanece elevada aún después de que el estímulo infeccioso haya desaparecido, lo que limita su aplicación en el seguimiento terapéutico. Además, no se correlaciona con la gravedad de la respuesta inflamatoria, ni aporta valor pronóstico de sepsis. No obstante, es un marcador ampliamente utilizado.
La determinación de PCT es un marcador precoz, útil para la identificación de infección bacteriana, sepsis y shock séptico. Su especificidad aumenta con la concentración. Además, niveles persistentemente elevados indican peor pronóstico. Las mediciones seriadas cobran importancia frente a la aislada.
A pesar de que aún no se ha encontrado un marcador bioquímico realmente eficaz para el diagnóstico de sepsis, se siguen realizando esfuerzos para encontrar parámetros que aumenten la eficacia diagnóstica y el valor pronóstico. Esto permitiría disminuir la morbi-mortalidad en este tipo de pacientes, ahorrar pruebas complementarias innecesarias, disminuir gastos, ingresos y estancias hospitalarias y reducir la utilización injustificada de antibióticos con la consecuente aparición de resistencias.
Quizás, el uso conjunto de determinados biomarcadores en función de la situación de cada paciente y la utilización de determinaciones seriadas teniendo en cuenta las ventajas y las limitaciones de cada uno de ellos ayuden a la diferenciación de los cuadros clínicos.
BIBLIOGRAFÍA
-
American College of Chest Physicians /Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992; 20:864-74.
-
Brun-Buisson C. The epidemiology of the systemic inflammatory response. Intensive Care Med. 2000;26(1):64-74.
-
Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med 2003; 31:1250-6.
-
Desouza I, Franco-Penteado C, Camargo E, Lima C, Teixeira S, Muscará M,Nucci G, Antunes E. Acute pulmonary inflammation by exposure of the airways tostaphylococcal enterotoxin type B in rats. Toxicol Appl Pharmacol 2006;217(1):107-113.
-
Chaves F, Tierno B, Xu D. Neutrophil volume distribution width. Arch PatholLab Med 2006;130(3):378-380.
-
Kofoed K et al. Use of plasma C-reactive protein, procalcitonin, neutrophils, macrophage migratory inhibitory factor, soluble urokinasa-type plasminogen activator receptor and soluble triggering receptor expressed on myeloid cells-1 in combination to diagnose infections: a prospective study. Crit Care 2007;11(2):R38.
-
Castelli GP et al. Procalcitonin and C-reactive protein during systemic inflammatory response syndrome, sepsis and organ dysfunction. Crit Care 2004;8(4):234-242.
-
Póvia P et al. Early identification of intensive care unit-acquired infections with daily monitoring of C-reactive protein: a prospective observational study. Crit Care 2006;10(2):R63.
-
Christ-Crain M, Müller B. Procalcitonin in bacterial infections- hype,hope, more or less? Swiss Med Wkly 2005;135:451-60.
-
Jensen JU, Heslet L, Jensen TH, Espersen K, Steffensen P, Tvede M. Procalcitonin increase in early identification of critically ill patients at high risk of mortality. Crit Care Med 2006;34:2596-602.
-
Sponholz C, Sakr Y, Reinhart K, Brunkhorst F. Diagnostic value and prognostic implications of serum procalcitonin after cardiac surgery: a systematic review of the literature. Crit Care. 2006;10(5):R145.
-
Mokart D, Merlin M, Sannini A, et al.. Procalcitonin, interleukin 6 and systemic inflammatory response syndrome (SIRS): early markers of postoperative sepsis after major surgery. Br J Anaesth. 2005 Jun;94(6):767-73.
-
Koussoulas V, Tzivras M, Karagianni V, et al. Monocytes in systematic inflammatory response syndrome: differences between sepsis and acute pancreatitis. World J Gastroenterol. 2006 Nov 7;12(41):6711-4.
-
Kellum JA, Kong L, Fink MP, et al. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Arch Intern Med. 2007 Aug 13-27;167(15):1655-63.
-
Chawla LS, Seneff MG, Nelson DR, et al. Elevated plasma concentrations of IL-6 and elevated APACHE II score predict acute kidney injury in patients with severe sepsis. Clin J Am Soc Nephrol. 2007 Jan;2(1):22-30.74.
-
Hensler T, Sauerland S, Lefering R, et al. The clinical value of procalcitonin and neopterin in predicting sepsis and organ failure after major trauma. Shock 2003; 20: 420 426.
-
Tasdelen Fisgin N, Aliyazicioglu Y, Tanyel E, et al. The value of neopterin and procalcitonin in patients with sepsis. South Med J. 2010 Mar;103(3):216-9.
-
Gibot S, Kolopp-Sarda MN, Bene MC, Cravoisy A, Levy B, Faune GC. Plasma level of a triggering receptor expressed on myeloid cells-1: Its diagnostic accuracy in patients with suspected sepsis. Ann Intern Med 2004: 141: 9-15.
-
Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert P. Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia. N Engl J Med 2004; 350: 451-8.
-
Dagan R. Soluble Triggering Receptor Expressed on Myeloid Cells-1 (sTREM-1) Level in Cerebrospinal Fluid of Children with Meningitis. 48th Annual ICAAC/IDSA 46th Annual meeting 2008; Abstract G2-1342; pg. 392.
-
Nishio K, Akai Y, Murao Y et al. Increased plasma concentrations of adrenomedullin correlate with relaxation of vascular tone in patients with septic shock. Crit Care Med 1997; 25: 953-7.
-
Christ-Crain M, Morgenthaler NG, Struck J, Harbarth S, Bergmann A, Müller B. Mid-regional pro-adrenomedullin as a prognostic marker in sepsis: an observational study. Crit Care. 2005;9:R816–24
-
Christ-Crain M, Morgenthaler NG, Stolz D et al. Proadrenomedullin, to predict severity and outcome in community-acquired pneumonia. Crit Care 2006; 10: 418.
-
Seligman R, Papassotiriou J, Morgenthaler NG, Copeptin, a novel prognostic biomarker in ventilator-associated pneumonia. Crit Care. 2008;12(1):R11.
-
Muller B, Morgenthaler N, Stolz D, et al. Circulating levels of copeptin, a novel biomarker, in lower respiratory tract infections. Eur J Clin Invest. 2007;37:145-52.
-
Stolz D, Christ-Crain M, Morgenthaler NG, et al. Copeptin, C-reactive protein, and procalcitonin as prognostic biomarkers in acute exacerbation of COPD. Chest. 2007 Apr;131(4):1058-67.
-
Guignant C, Voirin N, Venet F, et al. Assessment of pro-vasopressin and pro-adrenomedullin as predictors of 28-day mortality in septic shock patients. Intensive Care Med. 2009 Nov;35(11):1859-67.
-
Reichlin T, Hochholzer W, Stelzig C, et al. Incremental Value of Copeptin for Rapid Rule Out of Acute Myocardial Infarction. J Am Coll Cardiol 2009, 54(1):60-68.














Palabras Clave: citocinas., procalcitonina, proteína C reactiva, Sepsis, SIRS