EVALUACIÓN DE RESULTADOS TRAS IMPLEMENTAR UN PROTOCOLO DE TRATAMIENTO DE CANDIDEMIA EN PACIENTES NO NEUTROPÉNICOS
Raúl Pérez Serrano*, Hasania Abdel-Hadi Álvarez**, Élida Vila Torres*, María Luisa Moreno Perulero*, Raquel Lozano Toledo*, Carmen Encinas Barrios*.
*Servicio de Farmacia
** Servicio Medicina Intensiva
Hospital General Universitario de Ciudad Real.
AUTOR PARA CORRESPONDENCIA
Raúl Pérez Serrano
Hospital General Universitario de Ciudad Real
Servicio de Famacia
e-mail : rpserrano@sescam.jccm.es
Palabras clave: equinocandinas, antifúngicos, tratamiento empírico, candidemia y pacientes adultos no neutropénicos.
RESUMEN
Objetivo: Evaluar el impacto de un protocolo local de tratamiento antifúngico sobre el perfil de prescripción y el ahorro económico asociado.
Material y método: Estudio retrospectivo que compara dos periodos de un año de duración, uno previo y otro posterior a la implantación del protocolo. Para la evaluación del impacto se compara la dosis diaria definida por cada 100 estancias (DDD/100 e) de cada antifúngico en cada periodo.
Resultados: El consumo de antifúngicos se ha reducido en un 15,3%, todos los antifúngicos, excepto la anfotericina B liposomal han visto reducido su consumo. El gasto en este grupo de antimicrobianos se redujo en un 46,3%.
Conclusión: La protocolización del tratamiento antifúngico contribuye a la optimización del uso de estos fármacos, consiguiendo una utilización eficiente de los recursos económicos.
Keyword:echinocandins,antifungals,empirical treatment, candidemia andnon-neutropenicadult patients.
ABSTRACT
Objective: To assess the impact of local antifungal treatment protocol on prescription profile, as well as, the cost savingsassociated with thisintervention.
Methods: This is a retrospective study which compared two periods of one year of duration, one before and another one after the implementation of the protocol. We compared the defined daily dose per 100 stays (DDD/100 e) of all of antifungal in both periods.
Results: Antifungalconsumptionhas been reducedby 15.3%, all antifungalsexceptliposomalamphotericinBhavereduced their consumption. The cost of this antimicrobial group has decreased by 46.3%.
Conclusion: The implementation of antifungal treatment protocols contributes to optimize the use of these drugs, achieving an efficient use of economic resources.
INTRODUCCIÓN
Candida spp. es el principal microorganismo causal de micosis oportunista en el medio intrahospitalario, la incidencia de candidemia en España se estima en 4,3 episodios/100.000 habitantes, ocurriendo un 33-55% de estos en las Unidades de Cuidados Intensivos (UCI)1-2. Principalmente las infecciones por candida spp. ocurren en pacientes postoperados de cirugía abdominal, politraumatizados o grandes quemados3, con una tasa de mortalidad asociada que oscila entre 46-56%4. Aunque podría haber variaciones en función del área geográfica, los patrones generales de susceptibilidad de las especies de Candida a los diferentes antifúngicos se muestran en la tabla 15-6.
|
Patrones generales de susceptibilidad de las especies de Candida |
|||||
| Especie |
Fluconazol |
Itraconazol |
Voriconazol |
Anfotericina B |
Candinas |
| Candida albicans | S | S | S | S | S |
| Candida tropicalis | S | S | S | S | S |
| Candida parapsilosis | S | S | S | S | S a R* |
| Candida glabrata | S-DD a R | S-DD a R | S-DD a R | S a I | S |
| Candida krusei | R | S-DD a R | S | S a I | S |
| Candida lusitaniae | S | S | S | S a R | S |
| I: Susceptibilidad intermedia; R: resistente; S-DD: susceptibilidad dependiente de la dosis. *La resistencia a las equinocandinas en las cepas aisladas de C. parapsilosis espoco frecuente. | |||||
Tabla 1. Susceptibilidad de las especies de Candida
El impacto de las infecciones fúngicas sobre los costes sanitarios y económicos es elevado y motivo de una preocupación creciente7. El elevado impacto económico de la enfermedad, junto con una elevada tasa de mortalidad, hacen necesario conocer la eficiencia de los antifúngicos comercializados y valorar las indicaciones de uso a nivel intrahospitalario.
La dispensación de equinocandinas por el Servicio de Farmacia se realiza mediante solicitud individualizada por paciente por parte del facultativo prescriptor y previa validación por un facultativo farmacéutico que asegura el cumplimiento del protocolo aprobado por la Comisión de Farmacia y Terapéutica (CFyT) en 2011. Además, el farmacéutico periódicamente recomienda al prescriptor, si procede, el paso a vía oral y/o desescalada terapéutica.
OBJETIVOS
El objetivo principal del estudio es evaluar el impacto del protocolo sobre el perfil de prescripción de antifúngicos en el HGUCR tras un año de su aprobación.
Como objetivo secundario se establece valorar el ahorro económico que ha supuesto la implantación del protocolo.
MATERIAL Y MÉTODO
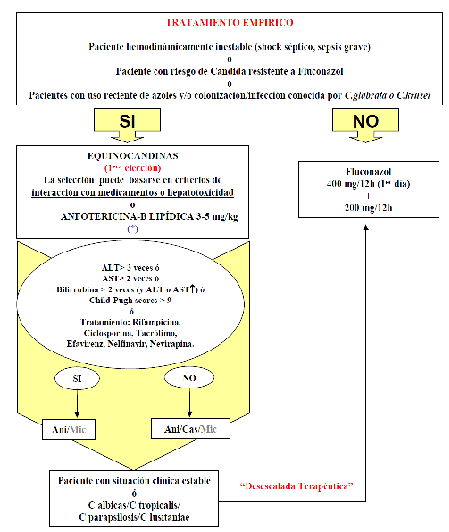
Con el objetivo de una utilización racional y eficiente de los antimicóticos, tras la revisión de la evidencia científica disponible, a finales del año 2011, la CFyT del Hospital General Universitario de Ciudad Real (HGUCR) aprueba un protocolo para el tratamiento empírico de candidemia/candidiasis en pacientes no neutropénicos, en el cual se contempla el uso de fluconazol como tratamiento empírico de elección, excepto en pacientes hemodinámicamente inestables, con riesgo de especies de candida resistente a azoles o uso reciente de azoles y/o colonización/infección conocida por C. glabrata o C. krusei en los cuales el tratamiento de elección sería una equinocandina (figura 1). Aunque las candinas, según las guías terapéuticas, están indicadas como tratamiento de primera elección de la candidemia, también fluconazol se posiciona con el mismo grado de recomendación8-9. Tal y como se ha propuesto en el protocolo del HGUCR, parece razonable que la elección de equinocandinas como tratmiento empírico deba reservarse para pacientes con enfermedad crítica o pacientes con exposición reciente a azoles.
Teniendo en cuenta que actualmente las equinocandinas disponibles en el HGUCR son caspofungina y anidulafungina, la elección de la equinocandina debe basarse en las interacciones con otros medicamentos, hepatotoxicidad o en último término en criterios de eficiencia, para lo que se añadió como anexo al protocolo una tabla con el coste económico de los diferentes antifúngicos en función del peso del paciente. Anidulafungina es la única candina que no requiere ajuste de dosis según peso, ni función hepática o renal, ni siquiera en aquellos pacientes que están sometidos a diálisis.
La difusión intrahospitalaria del protocolo se realizó por diferentes vías:
-
Envío desde la Dirección Médica a todos Jefes de Servicio en formato papel
-
Presentación en la Comisión de Infecciones y Política Antibiótica
-
Presentación en sesión general del hospital
-
Presentación en la UCI
-
Disponibilidad de acceso al protocolo a través de la intranet del hospital
Se trata de un estudio retrospectivo que compara dos periodos de un año de duración durante 2011 y 2012, previo y posterior a la implantación del protocolo respectivamente.
Para la evaluación del impacto del protocolo se calculó la dosis diaria definida (DDD) por cada 100 estancias (DDD/100 e) de cada uno de los antifúngicos, a partir del consumo y las estancias anuales, según la siguiente fórmula:
*Expresado en gramos
La DDD se define como la dosis habitual de mantenimiento diaria de un fármaco utilizada para su principal indicación en adultos. Los antifúngicos evaluados serán los de mayor consumo: azoles (fluconazol, voriconazol e itraconazol), anfotericina B liposomal y equinocandinas (anidulafungina y caspofungina).
Para la valoración económica del gasto en antifúngicos se utilizó el precio medio de compra.
Tanto para calcular consumo (DDD/100 e) como el gasto económico se utilizó la aplicación informática para la gestión económica del Servicio de Farmacia. No se incluyeron aquellos consumos que no generan estancia hospitalaria, como el Servicio de Urgencias o centros de día.
Se realizó una prueba de comparación de medias con el estadístico t de student para muestras dependientes, con el fin de analizar la variación del consumo de los diferentes grupos de antifúngicos entre ambos periodos. Para ello, se consideró muestra 1 a los consumos de los diferente antifúngicos durante 2011 y muestra 2 a los datos análogos de 2012, se trataron ambas muestras como dependientes y se analizaron estadísticamente las diferencias de los 6 antifúngicos entre ambos periodos. Se consideraron diferencias estadísticamente significativas cuando la p<0,05 y el intervalo de confianza 95% de las diferencias de las medias no incluía el 0.
RESULTADOS
En 2012 el consumo de antifúngicos se ha reducido en un 15,3% (3,60 vs 4,25 DDD/100 e). Como puede observarse en la tabla 2, se ha reducido el consumo de todos ellos, excepto la anfotericina B liposomal. El consumo de equinocandinas se redujo en un 41,8%.
|
2011 |
2012 |
|
|
Fluconazol |
3,06 |
2,69 |
|
Itraconazol |
0,32 |
0,28 |
|
Voriconazol |
0,20 |
0,10 |
|
Anfotericina B liposomal |
0,07 |
0,18 |
|
Caspofungina |
0,31 |
0,18 |
|
Anidulafungina |
0,29 |
0,17 |
|
TOTAL |
4,25 |
3,60 |
Tabla 2. Comparativa del consumo de antifúngicos en los dos periodos (DDD/100 e)
La reducción del consumo entre ambos periodos resultó estadísticamente significativa, con una disminución total de 0,65 DDD/100 e (IC95: 0,486 – 0,814) y p=0,0002 en la prueba t de Student para comparación de muestras dependientes.
En la figura 2 puede observarse una comparativa del perfil de prescripción, medido en porcentaje de consumo (DDD/100 e) entre ambos periodos. Tras la difusión del protocolo, se utilizaron en mayor proporción fluconazol y anfotericina B liposomal y se redujo el consumo de caspofungina, anidulafungina y voriconazol.
En cuanto al gasto en antifúngicos en 2012 se redujo un 46,3%, disminuyendo el gasto de todos los antifúngicos, a excepción nuevamente de anfotericina B liposomal que ascendió.
|
2011 |
2012 |
|
|
Fluconazol |
8.694 |
5.236 |
|
Itraconazol |
1.227 |
1.044 |
|
Voriconazol |
33.853 |
17.143 |
|
Anfotericina B liposomal |
8.914 |
22.497 |
|
Caspofungina |
208.786 |
98.967 |
|
Anidulafungina |
157.576 |
80.000 |
|
TOTAL |
419.050 |
224.887 |
Tabla 3. Comparativa del gasto en antifúngicos en los dos periodos (euros)
DISCUSIÓN
En la toma de decisiones sanitarias aparece la necesidad de utilizar como criterio adicional al de la evidencia clínica, el de la evaluación de la eficiencia y del análisis de costes e impacto presupuestario de las distintas opciones terapéuticas. Algunos hospitales están considerando al tratamiento de las infecciones fúngicas como un foco de gasto farmacológico de muy alto nivel, viéndose obligados a desarrollar programas de vigilancia y control presupuestario.
El uso de antifúngicos como tratamiento empírico no debe ser generalizado, por lo que necesitamos seleccionar correctamente a los enfermos para evitar el uso indiscriminado de estos antibióticos, ya que ello sólo acarreará complicaciones, como toxicidad, interacciones farmacológicas, posibilidad de adquisición de resistencias y aumento de los costes10. La selección de una terapia antibiótica apropiada es complicada debido a varios factores que incluyen el elevado número de moléculas disponibles, la presencia de patógenos resistentes a las mismas y la tendencia a la prescripción de las últimas novedades aparecidas en el mercado de los antimicrobianos11, por lo que la protocolización puede ser una ayuda para los facultativos para asegurar la optimización de los tratamientos antimicrobianos.
En el caso del protocolo del estudio, una vez alcanzado el consenso de un equipo multidisciplinar que incluía a los servicios mayoritariamente implicados en la prescripción, como internistas e intensivistas se realizaron diversas acciones para la difusión y educación en el tratamiento antifúngico, pero además se acompañó de una medida restrictiva en el caso de equinocandinas que trata de garantizar el cumplimiento del protocolo mediante la petición de un formulario previo a la dispensación, dónde el facultativo prescriptor justifica la necesidad del tratamiento. Diseñar políticas de utilización de antimicrobianos entre especialistas comprometidos con la optimización del tratamiento, junto con una adecuada difusión de las recomendaciones aumenta las posibilidades de éxito. Aunque es necesario actualizarlo continuamente para disminuir el margen de error en la actividad diaria12.
El ahorro económico obtenido es superior a otras iniciativas puestas en marcha en otros hospitales españoles13, el mayor responsable ha sido la reducción casi a la mitad del uso de equinocandinas y probablemente es ahí donde debamos concentrar nuestros esfuerzos para garantizar la optimización del uso de antimicóticos. El aumento del consumo de anfotericina B liposomal no se puede explicar por la difusión del protocolo, y aunque no se ha demostrado por no ser objetivo del presente estudio, probablemente se deba a que durante 2012 algunos pacientes han sufrido infecciones poco frecuentes y con tratamientos largos, como meningoencefalitis por Cryptococcus neoformans o mucormicosis por hongos del género Rhizopus, donde el tratamiento de primera elección incluye anfotericina B liposomal14.
Limitaciones
El protocolo no incluye a todos los pacientes candidatos a la prescripción de algún antifúngico, aborda únicamente el tratamiento de la candidemia y sólo se incluye a pacientes no neutropénicos, pero las limitaciones en el diseño del estudio hacen que los resultados se hayan medido en todos los pacientes tratados con antifúngicos durante el periodo de estudio, aún así, los resultados han sido estadísticamente significativos. Si entre los criterios de exclusión se hubiese incluido al paciente neutropénico probablemente los resultados hubiesen sido aún mejores. Además, hubiese sido interesante y probablemente tendría que realizarse en un futuro, relacionar los consumos con las resistencias a antifúngicos, para poder establecer posibles modificaciones en los patrones de sensibilidad iniciales.
No haber medido durante el periodo de estudio la tasa de infección fúngica y/o mortalidad, puede sembrar cierta incertidumbre sobre la efectividad del tratamiento, aunque esta duda queda resuelta en parte, ya que el protocolo está avalado por la evidencia científica actual.
CONCLUSIONES
La protocolización del tratamiento antifúngico contribuye a la optimización de estos fármacos, consiguiendo un uso eficiente de los recursos económicos.
Para conseguir que estos resultados se mantengan será necesaria la actualización periódica del protocolo y el seguimiento del consumo, ya que la prescripción de antimicrobianos se encuentra influenciada por cambios y novedades frecuentes, no sólo desde el punto de vista farmacológico sino también microbiológico y diagnóstico.
BIBLIOGRAFÍA
-
Almirante B, Rodríguez D, Park BJ, Cuenca-Estrella M, Planes AM, Almeda M, et al. Barcelona Candidemia Project Study Group. Epidemiology and predictors of mortality in cases of Candida bloodstream infection: result from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol. 2005;43: 1829-35.
-
Bouza E, Muñoz P. Epidemiology of candidemia in intensive care units. Int J Antimicrob Agent. 2008;32 Suppl 2: S87-91.
-
Jarvis WR. Epidemiology of nosocomial fungal infections, whit emphasis on Candida species. Clin Infect Dis. 1995;1526-30.
-
Marriot D, Playford EG, Chen S, Slavin M, Nguyen Q, Ellis D, et al. Determinants of mortality in non-neutropenic ICU patients with candidaemia. Critical Care. 2009;13:R115.
-
Pfaller MA, Diekema DJ, Sheehan DJ. Interpretive breakpoinsts for fluconazole and Candida revisited: a blueprint for the future of antifungal susceptibility testing. Clin Microbiol Rev. 2006; 19:435-47.
-
Clinical and Laboratory Standards Institute (CLSI): reference method for broth dilution antifungal susceptibility testing of yeast: Aproved standart, 3rd ed. CLSI document M27-A3. Wayne, PA: CLSI, 2008.
-
García-Vargas M, Casado MA, Mir N, Barrueta JA. Análisis de costes de tres candinas en el tratamiento de la candidiasis invasora en pacientes adultos no neutropénicos en España. Farm Hosp. 2012;36(4):207-15.
-
Aguado JM, Ruiz-Camps I, Muñoz P, Mensa J, Almirante B, Vázquez L, et al. Recomendaciones sobre el tratamiento de la candidiasis invasiva y otras infecciones por levaduras de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Actualización 2011. Enferm Infecc Microciol Clin. 2011;29 (5): 345-61.
-
Pappa PG, Kauffman CA, Andes D, Benjamin DK et al. Clinical practice guidelines for the management of candidiasis: 2009 Update by infectious diseases society of America (IDSA). Clin Infect Dis 2009; 48:503-35.
-
Borges Sá M. Actualización sobre el tratamiento de las infecciones fúngicas graves. Rev Esp Quimioter. 2008. 21 (Supl Esp 1): 14-25.
-
Niederman MS. Appropiate use of antimicrobial agents: challenges and strategies for improvement. Crit Care Med. 2003; 31:608-16.
-
Sanz Ortiz J. Formación continuada: encricijada difícil. Med Clin (Bar). 1998; 111:496-8.
-
Cáliz Hernández B, Rodríguez González CG, Valerio Minero M, Muñoz García P, Bouza Santiago E, Sanjurjo Sáez M. Eficiencia de un programa “Antifungals Stewardship” (Proyecto PROMULGA). Farm Hosp. 2013;Supl. 1:1-7.
-
Mensa J, Gatell JM, García-Sánchez JE, Letang E, López-Suñé E, Marco F. Guía Terapéutica Antimicrobiana. Edición 2013.

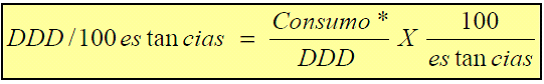














Palabras Clave: antifúngicos, Candidemia, candidemia y pacientes adultos no neutropénicos, equinocandinas, Neutropénico, tratamiento empírico