EOSINÓFILO: “EL SEÑOR DE LOS ANILLOS” ESOFÁGICOS. UNA BATALLA A LIBRAR EN LA PRÁCTICA CLÍNICA DIARIA.
Rodríguez-Sánchez, J. *, **
* Sección de Aparato Digestivo. Hospital Gutiérrez Ortega. Valdepeñas.(Ciudad Real)
** Grupo Multidisciplinar de EoE (HGUCR/HV).
Aceptado en Noviembre 2012
Palabras clave:, esofagitis eosinofílica, disfagia, GERD, Eosinofilos.
Resumen:
La esofagitis eosinofílica, es una realidad patente en la práctica clínica, suponiendo la principal causa de disfagia en pacientes jóvenes y el trastorno gastrointestinal mediado por eosinófilos más frecuente. A pesar de ello y tras 35 años desde su primera descripción, siguen existiendo incógnitas en su diagnóstico difíciles de despejar a pesar de la existencia de dos guías de consenso publicadas. Este hecho plantea múltiples obstáculos con los que día a día, el clínico tiene que enfrentarse.
El objetivo de este artículo, es analizar cada una de las facetas del diagnóstico de la enfermedad, haciendo especial énfasis en las áreas de penumbra existente.
Abreviaturas utilizadas:
EoE: Esofagitis eosinofílica.
ERGE: Enfermedad por reflujo gastroesofágico.
CGA: campo de gran aumento.
ECP: Proteina catiónica del eosinófilo.
MBP: Proteina básica principal.
EDN: Neurotoxina derivada del eosinófilo.
IL: interleukina.
IG: inmunoglobulina.
TNF: Factor de necrosis tumoral.
Th: T-helper.
Número de Palabras: 3.114
INTRODUCCIÓN
La esofagitis eosinofílica (EoE), se define como una enfermedad crónica inmuno/antígeno mediada, caracterizada por síntomas de disfunción esofágica, fundamentalmente disfagia e impactaciones alimentarias en población adulta, asociado a un infiltrado inflamatorio con predominio de eosinófilos en las biopsias de esófago (≥15 eosinófilos/campo de gran aumento) (1).
Fue descrita por primera vez por Landres y cols. (2) sobre un paciente con Achalasia vigorosa, pero no es hasta la segunda mitad de la década de los 90 cuando se comienzan a sentar las bases de su diagnóstico y tratamiento (3-5). Hoy en día representa la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico, la primera causa de impactación por alimentos en pacientes jóvenes, y por tanto el trastorno eosinofílico más frecuente del aparato digestivo (6).
Si revisamos el número de publicaciones en MEDLINE que tratan sobre EoE en los últimos años, detectamos una curva exponencial que pone de manifiesto el interés creciente de la comunidad médica en esta patología. Así desde 2005-2010, se publicaron un total de 513 manuscritos, pero en los últimos 2 años (2010-2012), han sido indexados un total de 409 (hasta noviembre de 2012), por lo que es probable que en 2015 se doble esta cifra (Figura 1).
Figura 1. Publicaciones indexadas en Pubmed sobre EoE (1978-2012). Fuente: http://www.ncbi.nlm.nih.gov/pubmed
Debido a esta creciente producción científica, en 2007 se publica la primera guía de consenso (7), siendo esta actualizada en 2011 (1), resumiéndose en tres pilares fundamentales: es una entidad clínico-patológica, con afectación exclusiva del esófago, habiendo descartado otros procesos que provocan infiltración inflamatoria mediada por eosinófilos (síndromes hipereosinófilos, Enfermedad inflamatoria intestinal, parasitosis…).
ESOFAGITIS EOSINOFÍLICA EN NUESTRO MEDIO:
Desde las primeras series de casos publicados en la década de los 90 (3, 4, 8), han sido comunicados casos de todos los continentes excepto de África, considerándose un trastorno típico de países occidentales y áreas con nivel socioeconómico elevado. Afecta a todas las razas, sexos y rangos de edad, con predominio en varones jóvenes de raza caucásica. Esta afectación con predominio en varones se da tanto en adultos como en población pediátrica, siendo en ambas cercana al 70% (7).
Cherian y cols. (9), estudiaron los factores epidemiológicos de EoE sobre una población pediátrica australiana, detectando como en un periodo de diez años (1995-2004), la prevalencia de la enfermedad pasó de 0,5 por 100.000 habitantes a 8,9 por 100.000 habitantes, lo que supone un valor 18 veces superior al registrado en 1995. Liacouras y cols. (10) realizaron otro análisis en el mismo periodo de tiempo, pero sobre población pediátrica americana, encontrando una prevalencia 35 veces superior en 2004 que la hallada en 1994. Este incremento en la prevalencia, también fue observado por Noel y cols.(11) en un periodo más corto de tiempo (2000-2003) sobre una población del condado de Hamilton (Cincinnati, OH. EEUU), donde pasó de 10 por 100.000 habitantes a 43 por 100.000 habitantes, y recientemente ha sido estimada en 52 casos por 100.000 habitantes (12).
En cuanto a la prevalencia de la enfermedad en población europea, en 2011 Hruz y cols. (13) comunicaron sobre una población suiza una prevalencia de 42,8 por 100.000 habitantes. En el mismo trabajo, desglosan la prevalencia desde 1989 a 2009 en periodos de 3 años, apreciándose como esta prácticamente se duplica en cada intervalo de tiempo, partiendo de 3,6 por 100.000 habitantes en 1989. Hecho similar fue observado con la tasa de incidencia anual, la cual se situó en término medio en 2,45 casos por 100.000 habitantes, observándose un incremento marcado de esta en el periodo de 2004 a 2009.
Sin embargo, en otro estudio realizado en Irlanda O´Donnell y cols.(14) detectaron como sobre 11.072 biopsias de esófago, en 1.364 (12,3%) apreciaron datos de esofagitis, y en tan sólo 13 casos (0,1%) datos histológicos compatibles con EoE. Con un diseño similar Vindigni y cols. (15) observaron como sobre 525 especímenes de biopsia tomados en pacientes con sospecha de enfermedad por reflujo gastroesofágico, en 20 (4%) se apreciaron datos compatibles con EoE.
En un estudio publicado recientemente y realizado en nuestro medio, Arias y cols. (16) comunican una prevalencia en un periodo de 2005 a 2011 de 44,62 casos por 100.000 habitantes, con una incidencia anual de 6,37 casos por 100.000 habitantes, siendo esta 3 veces mayor que en otras series publicadas a nivel Europeo (13). Los autores del trabajo español, justifican esta diferencia en la incidencia en el retraso sufrido en el diagnóstico de la enfermedad que en su serie se sitúa en 51 meses, pero con una variabilidad importante (de 1 mes a 168 meses), de tal forma que hasta 2006 no comenzó a diagnosticarse. En nuestro centro ocurre un hecho similar, y en base a los datos recogidos desde 2006 hasta 2012 (noviembre) por el grupo multidisciplinar de EoE (HGUCR/HV), con un total de 119 casos diagnosticados, la EoE presenta una prevalencia de 48 casos por 100.000 habitantes (datos no publicados).
RETOS PARA EL BIÓLOGO:
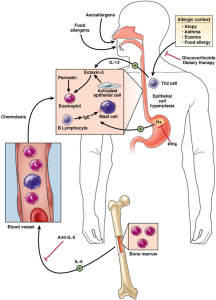
A pesar de que el mecanismo fisiopatológico no ha sido claramente determinado, existen evidencias de que se trata de una reacción alérgica mediada por linfocitos T helper tipo 2 (Th2), en individuos genéticamente predispuestos. De forma resumida (figura 2), la respuesta Th2 mediada, se induce en primer término por una sobre activación de linfocitos B, debido a la exposición de estos a determinados antígenos, que provocan la sobre expresión de IgE. Esta IgE provoca una activación del mastocito, que a su vez segrega Interleucina-5 (IL-5), que actúa como factor quimiotáctico y activador del eosinófilo. Una vez que se produce la activación del eosinófilo, éste comienza a segregar enzimas proteolíticas almacenadas en sus gránulos: proteína básica principal (MBP), neurotoxina derivada del eosinófilo (EDN) y la proteína catiónica del eosinófilo (ECP). A parte de su función proteolítica, estas enzimas son capaces de activar a las células dendríticas tisulares mediante los “toll like receptors-2” (TLR-2) y polarizarlas hacia linfocitos Th2, lo cual a su vez es favorecido por la síntesis de IL-13 e IL-4. La síntesis de TNF-α, da lugar a la activación de células epiteliales y la posterior síntesis de eotaxina-3, que actúa también como activador del eosinófilo. Son varios los estudios que ponen de manifiesto una sobre expresión del mRNA de eotaxina-3 en el epitelio esofágico de pacientes con EoE (17, 18). La IL-13, juega un papel fundamental ya que ha demostrado ser capaz de inducir la síntesis de eotaxina-3 en cultivos celulares, y promover la activación de fibroblastos mediante la síntesis de TGF-β por parte de los macrófagos (19). Sin embargo, en la práctica clínica, resulta difícil demostrar la existencia de fibrosis subepitelial debido a la escasa cantidad de tejido submucoso que proporcionan las biopsias.
Figura 2. Fisiopatología de EoE. Modificado de Rothenberg y cols.(57)
En definitiva se trata de una reacción alérgica mixta (tipo 1 y tipo 4) a alérgenos respiratorios y/o alimentarios, cuyo fruto es una activación de la cascada inflamatoria mediada por eosinófilos y linfocitos Th2 que trae consigo un remodelamiento del tejido esofágico afecto, con un incremento de la fibrosis y por tanto un deterioro en la actividad peristáltica del órgano.
RETOS PARA EL CLÍNICO:
De acuerdo con la guía de consenso vigente (1), no existen síntomas específicos de la enfermedad, y estos varían en función de varios factores como la edad, de este modo en población pediátrica es típica la presencia de dificultad para la ingesta, dolor epigástrico y vómitos, así como alteraciones del crecimiento (20). Sin embargo en adolescentes y adultos, la disfagia es el síntoma predominante. En base a esto, Mackenzie y cols. (21) realizaron un análisis prospectivo de la presencia de EoE en 261 pacientes que consultaron por disfagia, encontrando una prevalencia de la enfermedad del 12%. Resultados similares fueron obtenidos por Prasad y cols.(22) sobre 376 pacientes con disfagia. Se ha comunicado que la presencia de impactaciones alimentarias, oscila entre el 33% y el 54% (23). En el pasado número de octubre de 2011 de esta revista (24), comunicamos como en nuestro medio la EoE es un hecho frecuente en la urgencia por impactación de cuerpo extraño, presente como diagnóstico de sospecha en el 19% de los casos y con diagnóstico confirmado en 13%, siendo el segundo diagnóstico más frecuente tras el anillo de Schatzki. Debemos insistir a la hora de realizar una adecuada historia clínica, ya que muchos pacientes enmascaran los síntomas, ya que de forma involuntaria desarrollan mecanismos compensatorios para facilitar la deglución (25).
La EoE se ha discutido como posible causa de ERGE refractario a tratamiento con IBPs (26), sugiriendo algunos autores que el despistaje de EoE en ERGE refractario sería un abordaje coste-efectivo (27). Existen estudios que evalúan la presencia de EoE en pacientes con ERGE refractario (28-31), y si analizamos de forma global los resultados, nos encontramos que sobre 426 pacientes incluidos, tan solo en 14 encontramos la enfermedad (3,3%) (32).
En un reciente estudio, Sperry y cols. (33) analizan sobre 208 casos de EoE, la influencia que la raza y el sexo tienen sobre la presentación clínica de la enfermedad, observando como en caucásicos se produce menor tasa de fallo en el crecimiento en comparación con afroamericanos (9% vs. 30%;p=0,002), y una mayor proporción de esófagos anillados (41% vs. 12%; p=0,005). En cuanto al sexo, los autores comunican que en varones se produce mayor tasa de disfagia e impactaciones alimentarias (71 vs. 53%, p=0,02 y 35 vs. 20%, p=0,05, respectivamente).
En cuanto a los marcadores serológicos de actividad de la enfermedad es controvertido ya que aún quedan aspectos por resolver (34). En cuanto al recuento de eosinófilos en suero tenemos que establecer un punto de corte específico para la enfermedad, correlacionar los niveles con la existencia de enfermedades atópicas concomitantes, variabilidad estacional a causa de alérgenos respiratorios y su correlación con el recuento de eosinófilos en las biopsias de esófago.
En cuanto a IgE total, se han descrito niveles elevados del 4% al 69% de los adultos con EoE (34-36), pero su papel como marcador de actividad de la enfermedad es controvertido, ya que nuevamente su variabilidad estacional juega un papel importante en este aspecto, lo cual es posible que pueda influir en la historia clínica de la enfermedad, de hecho Wang y cols. (37) reportaron una menor incidencia de EoE en población infantil en los meses de invierno comparado con otras estaciones, hecho que fue constatado por Almansa y cols. (38). En cuanto a ECP en suero, no hemos encontrado estudios que evalúen su papel como marcador de actividad de EoE. Teniendo en cuenta que la prevalencia de alergias alimentarias elevada en estos pacientes (95% en nuestra serie), Schwab y cols. (39) comprobaron como pacientes con alergias alimentarias presentaban niveles elevados de ECP en aspirado de íleon terminal en comparación con controles sanos. Centrándonos en EoE, recientemente Furuta y cols.(40) han publicado un interesante trabajo, donde determinan los niveles de ECP en secreciones intraluminales de esófago mediante un sistema denominado Enterotest, correlacionándose estos con el recuento de eosinófilos en las biopsias. Otros marcadores de actividad recientemente estudiado son la EDN y la eotaxina-3, así Konikoff y cols. (41), demostraron sobre una población pediátrica de 47 pacientes como EDN y eotaxina-3 se correlacionaban de forma significativa con la densidad de eosinófilos encontrada en las biopsias de esófago. Recientemente Subbarao y cols. (42) comprobaron como los niveles séricos de EDN se correlacionaba con la actividad clínica de la enfermedad, siendo a la vez superiores a los hallados en un grupo control.
RETOS DEL ENDOSCOPISTA:
Las manifestaciones endoscópicas que se producen en la EoE, son el producto de la reacción inflamatoria descrita previamente y los fenómenos de remodelación y fibrosis que acontecen en la pared esofágica. Se han comunicado resultados dispares en cuanto a los hallazgos endoscópicos, siendo estos normales hasta en el 32% de los pacientes (10). Es probable que sobre estos resultados influya la gran variabilidad interobservador en la identificación de hallazgos endoscópicos típicos de la enfermedad, de este modo Peery y cols. (43) analizaron este hecho encontrando una variabilidad aceptable en la detección de pseudoanillos (k=0,56) y surcos longitudinales (k=0,48), pero una variabilidad interobservador inaceptable en la detección de exudados blanquecinos (k=0,29) y “mucosa normal” (k=0,34). Estos hallazgos no eran mejorados con la aplicación de cromoendoscopia virtual Narrow Band Imaging. Para intentar mejorar estos resultados, se ha publicado algún estudio analizando la utilidad de la cromoendoscopia con colorantes inertes en el diagnóstico de EoE, así Lucendo y cols. (44) estudiaron como el indigocarmín mejoraba la sensibilidad en la detección de surcos longitudinales: 2±1.4 / 4.2±1.12 (p<0.001); mucosa en “papel de crêpe”: 1.4±1,4 / 2.3±1.6 (p<0.001); pseudoanillos: 2±1.7 / 3±1.8 (p<0.001); y “mucosa empedrada”: 1.5±1.5 / 2.6±1.7 (p<0.001). Aun así, y dado el escaso número de trabajos que analizan este procedimiento, su práctica no está establecida.
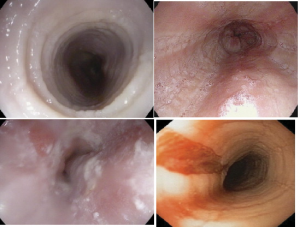
La pérdida del patrón vascular, es un hecho comunicado en el 93% de los pacientes con EoE. Sin embargo los hallazgos más frecuentemente descritos son la presencia de pseudoanillos, como fruto de las contracciones simultáneas de la capa muscular, y la presencia de surcos longitudinales, debido a la reacción inflamatoria de la capas mucosa y submucosa del esófago, apareciendo en el 25%-100% de los casos (45) (Figura 3). Es importante resaltar que ninguno de estos hallazgos es patognomónico de la enfermedad.
Figura 3. Hallazgos endoscópicos de EoE. A: pseudoanillos, B: exudados blanquecino, C: surcos longitudinales, D: Desgarro mucoso tras el paso de la óptica en un esófago en papel de crepé. Modificado de Ali y cols. (32).
De acuerdo con la actual guía de consenso, se recomienda la toma de 2 a 4 biopsias en esófago proximal y esófago distal (1), ya que si tomamos el punto de corte establecido de más de 15 eosinófilos por campo de gran aumento (CGA), la sensibilidad en el diagnóstico aumenta a medida que tomamos más muestras, siendo para 2, 3, 6 muestras del 84%, 97% y 100% respectivamente (46). Esto cobra especial importancia si tenemos en cuenta que la distribución de los eosinófilos a lo largo del esófago no es regular, si no parcheada (47).
No debemos olvidar, que al tratarse de un esófago inflamado, existe la posibilidad de presentar un incremento sustancial en la tasa de desgarros y perforaciones en el momento de la endoscopia (48, 49), sin embargo este hecho que parece lógico no ha sido constatado en series amplias de casos.
RETOS DEL PATÓLOGO:
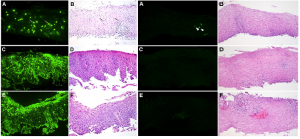
Se ha establecido como punto de corte para el diagnóstico de EoE la presencia ≥15 eosinófilos/CGA (1), pero en base a esto se ha sugerido la posibilidad de infradiagnosticar la enfermedad. De hecho, Ravi y cols. (50) observaron cómo un 35% endoscopias con toma de biopsias, cumplían los criterios de EoE (≥15 eosinófilos/CGA), esta entidad fue designada por los autores como EoE de bajo grado, lo cual hoy en día no se tiene en cuenta, descartando la enfermedad si el paciente presenta 20 eosinófilos/CGA. De estos 40 pacientes: en 6 (15%) fueron diagnosticados de EoE, en 2 (5%) coexistía EoE y ERGE, 28 (70%) fueron diagnosticados exclusivamente de ERGE, y 2 (5%) pacientes de acalasia y divertículo esofágico exclusivamente. En este mismo estudio se comunicó un pico máximo de 131 eosinófilos/CGA. Debido a todo esto, el hecho de fijarnos tan sólo en el recuento de eosinófilos intraepiteliales puede conducirnos a errores de infra o sobre diagnóstico de la enfermedad. Por desgracia, no es posible distinguir EoE de ERGE tan sólo con datos histológicos, pero si podemos inclinarnos al diagnóstico por una u otra en función de otros hallazgos histológicos más frecuentes en EoE. A propósito de esto, el Colegio Americano de Gastroenterología (AGC) (53) dividió los hallazgos histológicos en “Criterios Mayores” (imprescidibles para realizar el diagnóstico, pero no patognomónicos): ≥15 eosinófilos/GCA, microabscesos eosinofilicos definidos como agregados de más de 4 eosinófilos intraepiteliales, y “Criterios menores” (aquellos que ayudan al patólogo a establecer el diagnóstico): hiperplasia de la basal (>20% del grosor del epitelio), hipertrofia papilar en lámina propia (>75% del grosor del epitelio), aumento del número de linfocitos y mastocitos intraepiteliales, edema intercelular y fibrosis de la lámina propia. Sin embargo, teniendo en cuenta que las biopsias de esófago suelen ser muy superficiales, en ocasiones resulta muy difícil describir todos estos hallazgos. Otros autores, han determinado el valor de los productos de degranulación del eosinófilo en las biopsias mediante técnicas de inmunohistoquímica, como es el caso de Kephart y cols. (54) que demostraron el aumento significativo de gránulos de EDN en pacientes con EoE, a pesar de presentar un recuento en el número de eosinófilos límite para el diagnóstico (Figura 4).
Figura 4. A,C,E: IHQ para EDN en controles. B,D,F: Biopsias teñidas con H&E en controles. 1,3,5: IHQ para EDN en pacientes con EoE. 2,4,6: Biopsias teñidas con H&E en pacientes con EoE. Modificado de Kepart y cols. (54).
Aceves y cols. (55) demostraron como la presencia de signos de degranulación del eosinófilo era un signos muy específico de EoE (OR=157;p=0.00). De este modo, Mueller y cols. (56) demostraron el paralelismo existente entre el número de eosinófilos en las biopsias y la degranulación de proteína básica principal (MBP). Teniendo en cuenta todo esto, podemos establecer claras diferencias histológicas entre EoE y ERGE que nos orienten hacia el diagnóstico (Tabla1).
| Datos histológicos |
EoE |
ERGE |
| Degranulación de eosinófilos |
Predominante |
Muy infrecuente |
| Microabscesos eosinófilos |
Frecuente |
Infrecuente |
| Distribución intraepitelial de los eosinófilos |
Predominante |
Infrecuente (normalmente limitados al tercio inferior). |
| Hiperplasia de la basal |
Predominante (>50% del grosor del epitelio) |
En ocasiones (<25% del grosor del epitelio). |
| Vacuolización de queratinocitos |
Frecuente |
Frecuente |
| Edema de espacio intercelular |
Frecuente |
Frecuente |
| Fibrosis de lámina propia |
Frecuente |
Infrecuente |
| Hipertrofia de papilas |
Frecuente |
Frecuente |
Tabla 1. Comparativa de los hallazgos histológicos de EoE y ERGE. Modificado de Ali y cols. (32).
Hasta hace relativamente poco tiempo, los patólogos no solían informar del recuento exacto de eosinófilos, lo cual es de extrema importancia a la hora de tomar decisiones diagnósticas, al igual que la comunicación entre clínico y patólogo, donde se pongan en común tanto los hallazgos histológicos, como la clínica y los hallazgos endoscópicos. Aunque creemos que la distinción entre EoE y ERGE es un reto, en el mejor de los casos. También creemos que el diagnóstico anatomopatológico sin información clínica puede dar lugar a errores. En base a todo ello, en Marzo de 2012 se creó el Grupo Multidisciplinar de EoE, en el seno de dos hospitales de nuestra área (Hospital General Universitario de Ciudad Real y Hospital Gutiérrez Ortega de Valdepeñas), en cooperación con un Centro especializado en Nutrición y dietética (Clínica LASER de Madrid). Dicho grupo engloba a los servicios de Aparato Digestivo, Alergología, Pediatría y Anatomía patológica de ambos centros y el objetivo fundamental del mismo es el de consensuar pautas de actuación, elaborar protocolos, compartir información clínica relevante de un modo ágil y desarrollar la faceta de investigación desde una perspectiva global de la enfermedad sobre los pacientes con EoE atendidos en ambos centros. De este modo, se ha elaborado un Registro de la enfermedad, que actualmente cuenta con 119 pacientes diagnosticados de EoE y seguidos en una consulta monográfica habilitada para ello. Esto, nos está permitiendo conocer la realidad de la enfermedad en nuestro medio, y poder así compartir nuestra información con otros centros en el seno de estudios multicéntricos.
Como conclusión, a día de hoy podemos decir que la EoE es una realidad en la práctica clínica, pero sigue suponiendo un reto en el diagnóstico que obliga a una puesta en común entre clínicos y patólogos, preferiblemente en grupos de trabajo o sesiones intrahospitalarias. El hecho de crear grupos especializados, supone un motor y una concienciación colectiva en la búsqueda de la enfermedad, ya que como hemos visto su diagnóstico se puede retrasar hasta 5 años debido a que puede enmascararse tanto a los ojos del clínico como a los del patólogo.
BIBLIOGRAFÍA.
1. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: Updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011 Apr 6.
2. Landres RT, Kuster GG, Strum WB. Eosinophilic esophagitis in a patient with vigorous achalasia. Gastroenterology. 1978 Jun;74(6):1298-301.
3. Borda F, Jimenez FJ, Martinez Penuela JM, Echarri A, Martin Granizo I, Aznarez R. [Eosinophilic esophagitis: an underdiagnosed entity?]. Rev Esp Enferm Dig. 1996 Oct;88(10):701-4.
4. Van Rosendaal GM, Anderson MA, Diamant NE. Eosinophilic esophagitis: case report and clinical perspective. Am J Gastroenterol. 1997 Jun;92(6):1054-6.
5. Lucendo AJ, Carrion G, Navarro M, Pascual JM, Gonzalez P, Castillo P, et al. Eosinophilic esophagitis in adults: an emerging disease. Dig Dis Sci. 2004 Nov-Dec;49(11-12):1884-8.
6. Lucendo AJ, Sanchez-Cazalilla M. Adult versus pediatric eosinophilic esophagitis: important differences and similarities for the clinician to understand. Expert Rev Clin Immunol. 2012 Nov;8(8):733-45.
7. Furuta GT, Liacouras CA, Collins MH, Gupta SK, Justinich C, Putnam PE, et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology. 2007 Oct;133(4):1342-63.
8. Levine MS, Saul SH. Idiopathic eosinophilic esophagitis: how common is it? Radiology. 1993 Mar;186(3):631-2.
9. Cherian S, Smith NM, Forbes DA. Rapidly increasing prevalence of eosinophilic oesophagitis in Western Australia. Arch Dis Child. 2006 Dec;91(12):1000-4.
10. Liacouras CA, Spergel JM, Ruchelli E, Verma R, Mascarenhas M, Semeao E, et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol. 2005 Dec;3(12):1198-206.
11. Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med. 2004 Aug 26;351(9):940-1.
12. Spergel JM, Book WM, Mays E, Song L, Shah SS, Talley NJ, et al. Variation in prevalence, diagnostic criteria, and initial management options for eosinophilic gastrointestinal diseases in the United States. J Pediatr Gastroenterol Nutr. 2011 Mar;52(3):300-6.
13. Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol. 2011 Dec;128(6):1349-50 e5.
14. O’Donnell S, Kelly OB, Breslin N, Ryan BM, O’Connor HJ, Swan N, et al. Eosinophilic oesophagitis: an Irish experience. Eur J Gastroenterol Hepatol. 2011 Nov;23(12):1116-21.
15. Vindigni C, Villanacci V, Marini M, Rocca BJ, Frosini G, Pedruzzi E, et al. Eosinophilic esophagitis: an Italian experience. Rev Esp Enferm Dig. 2010 Jan;102(1):15-9.
16. Arias A, Lucendo AJ. Prevalence of eosinophilic oesophagitis in adult patients in a central region of Spain. Eur J Gastroenterol Hepatol. 2012 Oct 16.
17. Gupta SK, Fitzgerald JF, Kondratyuk T, HogenEsch H. Cytokine expression in normal and inflamed esophageal mucosa: a study into the pathogenesis of allergic eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2006 Jan;42(1):22-6.
18. Bhattacharya B, Carlsten J, Sabo E, Kethu S, Meitner P, Tavares R, et al. Increased expression of eotaxin-3 distinguishes between eosinophilic esophagitis and gastroesophageal reflux disease. Hum Pathol. 2007 Dec;38(12):1744-53.
19. Abonia JP, Blanchard C, Butz BB, Rainey HF, Collins MH, Stringer K, et al. Involvement of mast cells in eosinophilic esophagitis. J Allergy Clin Immunol. 2010 Jul;126(1):140-9.
20. Mukkada VA, Haas A, Maune NC, Capocelli KE, Henry M, Gilman N, et al. Feeding dysfunction in children with eosinophilic gastrointestinal diseases. Pediatrics. 2010 Sep;126(3):e672-7.
21. Mackenzie SH, Go M, Chadwick B, Thomas K, Fang J, Kuwada S, et al. Eosinophilic oesophagitis in patients presenting with dysphagia–a prospective analysis. Aliment Pharmacol Ther. 2008 Nov 1;28(9):1140-6.
22. Prasad GA, Talley NJ, Romero Y, Arora AS, Kryzer LA, Smyrk TC, et al. Prevalence and predictive factors of eosinophilic esophagitis in patients presenting with dysphagia: a prospective study. Am J Gastroenterol. 2007 Dec;102(12):2627-32.
23. Desai TK, Stecevic V, Chang CH, Goldstein NS, Badizadegan K, Furuta GT. Association of eosinophilic inflammation with esophageal food impaction in adults. Gastrointest Endosc. 2005 Jun;61(7):795-801.
24. Rodriguez Sanchez J, Verdejo Gil C, Lopez Viedma B, Martin Davila F, Hernandez Albujar A, Lorente Poyatos R. La esofagitis eosinofílica como causa de impactación por cuerpo extraño. Análisis de nuestra experiencia. Apunt cienc. 2011;Nov(3):20-8.
25. Katzka DA. Demographic data and symptoms of eosinophilic esophagitis in adults. Gastrointest Endosc Clin N Am. 2008 Jan;18(1):25-32; viii.
26. Richter JE. How to manage refractory GERD. Nat Clin Pract Gastroenterol Hepatol. 2007 Dec;4(12):658-64.
27. Miller SM, Goldstein JL, Gerson LB. Cost-effectiveness model of endoscopic biopsy for eosinophilic esophagitis in patients with refractory GERD. Am J Gastroenterol. 2011 Aug;106(8):1439-45.
28. Poh CH, Gasiorowska A, Navarro-Rodriguez T, Willis MR, Hargadon D, Noelck N, et al. Upper GI tract findings in patients with heartburn in whom proton pump inhibitor treatment failed versus those not receiving antireflux treatment. Gastrointest Endosc. 2010 Jan;71(1):28-34.
29. Sa CC, Kishi HS, Silva-Werneck AL, Moraes-Filho JP, Eisig JN, Barbuti RC, et al. Eosinophilic esophagitis in patients with typical gastroesophageal reflux disease symptoms refractory to proton pump inhibitor. Clinics (Sao Paulo). 2011;66(4):557-61.
30. Garcia-Compean D, Gonzalez Gonzalez JA, Marrufo Garcia CA, Flores Gutierrez JP, Barboza Quintana O, Galindo Rodriguez G, et al. Prevalence of eosinophilic esophagitis in patients with refractory gastroesophageal reflux disease symptoms: A prospective study. Dig Liver Dis. 2011 Mar;43(3):204-8.
31. Foroutan M, Norouzi A, Molaei M, Mirbagheri SA, Irvani S, Sadeghi A, et al. Eosinophilic esophagitis in patients with refractory gastroesophageal reflux disease. Dig Dis Sci. 2010 Jan;55(1):28-31.
32. Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc. 2012 Dec;76(6):1224-37.
33. Sperry SL, Woosley JT, Shaheen NJ, Dellon ES. Influence of race and gender on the presentation of eosinophilic esophagitis. Am J Gastroenterol. 2012 Feb;107(2):215-21.
34. Gupta SK. Noninvasive markers of eosinophilic esophagitis. Gastrointest Endosc Clin N Am. 2008 Jan;18(1):157-67; xi.
35. Remedios M, Campbell C, Jones DM, Kerlin P. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate. Gastrointest Endosc. 2006 Jan;63(1):3-12.
36. Baxi S, Gupta SK, Swigonski N, Fitzgerald JF. Clinical presentation of patients with eosinophilic inflammation of the esophagus. Gastrointest Endosc. 2006 Oct;64(4):473-8.
37. Wang FY, Gupta SK, Fitzgerald JF. Is there a seasonal variation in the incidence or intensity of allergic eosinophilic esophagitis in newly diagnosed children? J Clin Gastroenterol. 2007 May-Jun;41(5):451-3.
38. Almansa C, Krishna M, Buchner AM, Ghabril MS, Talley N, DeVault KR, et al. Seasonal distribution in newly diagnosed cases of eosinophilic esophagitis in adults. Am J Gastroenterol. 2009 Apr;104(4):828-33.
39. Schwab D, Raithel M, Klein P, Winterkamp S, Weidenhiller M, Radespiel-Troeger M, et al. Immunoglobulin E and eosinophilic cationic protein in segmental lavage fluid of the small and large bowel identify patients with food allergy. Am J Gastroenterol. 2001 Feb;96(2):508-14.
40. Furuta GT, Kagalwalla AF, Lee JJ, Alumkal P, Maybruck BT, Fillon S, et al. The oesophageal string test: a novel, minimally invasive method measures mucosal inflammation in eosinophilic oesophagitis. Gut. 2012 Aug 15.
41. Konikoff MR, Blanchard C, Kirby C, Buckmeier BK, Cohen MB, Heubi JE, et al. Potential of blood eosinophils, eosinophil-derived neurotoxin, and eotaxin-3 as biomarkers of eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2006 Nov;4(11):1328-36.
42. Subbarao G, Rosenman MB, Ohnuki L, Georgelas A, Davis M, Fitzgerald JF, et al. Exploring potential noninvasive biomarkers in eosinophilic esophagitis in children. J Pediatr Gastroenterol Nutr. 2011 Dec;53(6):651-8.
43. Peery AF, Cao H, Dominik R, Shaheen NJ, Dellon ES. Variable reliability of endoscopic findings with white-light and narrow-band imaging for patients with suspected eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2011 Jun;9(6):475-80.
44. Lucendo Villarin AJ, De Rezende LC, Gonzalez Castillo S, Hervías D, Yague-Compadre JL, Arias A. Chromoendoscopy with indigo-carmine improves the recognition of endoscopic mucosal findings in adult eosinophilic esophagitis. . Gastroenterology. 2009;136(S1874 (Suppl 1)).
45. Fox VL. Eosinophilic esophagitis: endoscopic findings. Gastrointest Endosc Clin N Am. 2008 Jan;18(1):45-57; viii.
46. Shah A, Kagalwalla AF, Gonsalves N, Melin-Aldana H, Li BU, Hirano I. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol. 2009 Mar;104(3):716-21.
47. Saffari H, Peterson KA, Fang JC, Teman C, Gleich GJ, Pease LF, 3rd. Patchy eosinophil distributions in an esophagectomy specimen from a patient with eosinophilic esophagitis: Implications for endoscopic biopsy. J Allergy Clin Immunol. 2012 Sep;130(3):798-800.
48. Sgro A, Betalli P, Battaglia G, Bardini R, Crivellaro MA, Svaluto G, et al. An unusual complication of eosinophilic esophagitis in an adolescent: intramural esophageal dissection. Endoscopy. 2012 Nov;44 Suppl 2:E419-20.
49. Liguori G, Cortale M, Cimino F, Sozzi M. Circumferential mucosal dissection and esophageal perforation in a patient with eosinophilic esophagitis. World J Gastroenterol. 2008 Feb 7;14(5):803-4.
50. Ravi K, Talley NJ, Smyrk TC, Katzka DA, Kryzer L, Romero Y, et al. Low Grade Esophageal Eosinophilia in Adults: An Unrecognized Part of the Spectrum of Eosinophilic Esophagitis? Dig Dis Sci. 2011 Feb 6.
51. Ravi K, Katzka DA, Smyrk TC, Prasad GA, Romero Y, Francis DL, et al. Prevalence of esophageal eosinophils in patients with Barrett’s esophagus. Am J Gastroenterol. 2011 May;106(5):851-7.
52. Rodrigo S, Abboud G, Oh D, DeMeester SR, Hagen J, Lipham J, et al. High intraepithelial eosinophil counts in esophageal squamous epithelium are not specific for eosinophilic esophagitis in adults. Am J Gastroenterol. 2008 Feb;103(2):435-42.
53. Odze RD. Pathology of eosinophilic esophagitis: what the clinician needs to know. Am J Gastroenterol. 2009 Feb;104(2):485-90.
54. Kephart GM, Alexander JA, Arora AS, Romero Y, Smyrk TC, Talley NJ, et al. Marked deposition of eosinophil-derived neurotoxin in adult patients with eosinophilic esophagitis. Am J Gastroenterol. 2010 Feb;105(2):298-307.
55. Aceves SS, Newbury RO, Dohil R, Schwimmer J, Bastian JF. Distinguishing eosinophilic esophagitis in pediatric patients: clinical, endoscopic, and histologic features of an emerging disorder. J Clin Gastroenterol. 2007 Mar;41(3):252-6.
56. Mueller S, Aigner T, Neureiter D, Stolte M. Eosinophil infiltration and degranulation in oesophageal mucosa from adult patients with eosinophilic oesophagitis: a retrospective and comparative study on pathological biopsy. J Clin Pathol. 2006 Nov;59(11):1175-80.
57. Rothenberg ME. Biology and treatment of eosinophilic esophagitis. Gastroenterology. 2009 Oct;137(4):1238-49.















Palabras Clave: disfagia, Eosinofilos., esofagitis eosinofílica, GERD