ESCLERODERMIA Y CÁNCER: ¿COINCIDENCIA O RELACIÓN PLAUSIBLE DE AMBAS ENFERMEDADES?
Párraga Prieto C.* Romero Aguilera G.**
* Servicio de Reumatología, ** Servicio de Dermatología. Hospital General Universitario de Ciudad Real
Autor para correspondencia:
Cristina Párraga Prieto (MIR de Reumatología).
Hospital General Universitario de Ciudad Real (HGUCR).
Dirección actual: C/Ciruela nº25,1ºD (Ciudad Real, España).
e-mail de contacto: crispi984@hotmail.com
Palabras clave: esclerodermia, anticuerpos antinucleares, cáncer.
Resumen:
Objetivo: Evaluar la frecuencia de cáncer en pacientes con esclerodermia (Sc), seguidos en el Hospital General de Ciudad Real, y posibles factores de riesgo clínicos y/o serológicos asociados al desarrollo de cáncer en estos sujetos.
Material y métodos: Realizamos un estudio observacional retrospectivo, incluyendo todos los pacientes con esclerodermia, seguidos en los servicios de Reumatología, Dermatología y Medicina Interna del Hospital General de Ciudad Real, desde Enero 1980 a Diciembre 2010. Las características clínicas y demográficas de los pacientes fueron comparadas mediante la prueba de Chi-cuadrado o exacta de Fisher. Los posibles factores asociados a cáncer, en nuestra muestra, fueron analizados mediante la prueba T-Student o U Mann-Whitney (p<0,05). El análisis de los datos fue realizado mediante el SPSS 18.0.
Resultados: Se identificaron 50 pacientes con esclerodermia en nuestra cohorte y 10 de estos desarrollaron cáncer (20%). El 50% de los enfermos fumadores presentaron tumor maligno. Los niveles medios de VSG y PCR fueron superiores en el grupo de casos en los que progresó la Sc (p= 0,018 y p=0,027). La positividad de los anticuerpos antinucleares se relacionó con el desarrollo de cáncer (p=0,034), progresión de Sc (p<0,001) y muerte (p=0,022).
Conclusiones: En nuestra cohorte de pacientes con esclerodermia se objetivó una elevada frecuencia de cáncer. Marcadores serológicos, como VSG, PCR y ANA, se relacionaron de forma significativa con progresión de la enfermedad reumatológica, muerte y desarrollo de tumor maligno en estos enfermos.
SCLERODERMA AND CANCER: COINCIDENCE OR A PLAUSIBLE RELATIONSHIP BETWEEN BOTH DISEASES?
Keywords: scleroderma, antinuclear antibodies, neoplasm.
Abstract:
Objective: To assess incidence of cancer among patients with scleroderma (Sc), followed in the General Hospital of Ciudad Real, and clinical / serological cancer risk factors in these subjects.
Methods: A retrospective observational study was performed, including all patients with scleroderma followed by Rheumatology, Dermatology and Internal Medicine department of the Hospital General de Ciudad Real (HGCR), from January 1980 to December 2010. Demographic and clinical features of subjects were compared using the Chi-square test or Fisher exact test. In our study, T-Student test or Mann-Whitney U was used to analyze possible cancer factors (p<0.05). The data analysis was carried out by SPSS v.18.0.
Results: Fifty patients with scleroderma were identified in our cohort, 10 of these developed neoplasms (20%). The 50% of patients with malignancy showed smoking. Mean levels of ESR and CRP were higher in the group of cases in which scleroderma progressed (p = 0.018 and p = 0.027). The antinuclear antibodies positivity was associated with tumor development (p = 0.034), progression of scleroderma (p < 0.001) and death (p = 0.022).
Conclusions: In our scleroderma patient’s cohort, we observed a high incidence of cancer. Serological markers such as ESR, CRP and ANA, were significantly associated with rheumatologic disease progression, death and cancer development in these patients.
INTRODUCCIÓN.
La esclerodermia (Sc) es una enfermedad del tejido conectivo caracterizada por daño endotelial, fibrosis y desregulación inmune humeral y celular, que afecta a la piel y órganos internos, en especial a los pulmones, riñones, corazón y tracto gastrointestinal1,2. A pesar de su baja prevalencia, la carga de la esclerodermia en España, definida por AVISA (años de vida saludables perdidos) y AVAD (años de vida ajustados por discapacidad), es alta3.
Las enfermedades autoinmunes sistémicas se asocian con una mayor incidencia de trastornos linfoproliferativos y de algunos tumores sólidos4,5. En relación a las conectivopatías, la dermatomiositis es la enfermedad que más estrechamente se ha vinculado con el cáncer. No obstante, Hill et al6 demuestran que el incremento de riesgo de cáncer objetivado en pacientes con esclerodermia se aproxima al observado en los sujetos con dermatomiositis, e incluso es superior al obtenido en la polimiositis. Así mismo, múltiples investigaciones recientes han demostrado un incremento del riesgo de cáncer en pacientes con esclerodermia (esclerosis sistémica), en especial los tumores hematológicos, pulmón, mama, piel y esófago2,4,5. Si bien, en comparación con las miopatías inflamatorias, pocos estudios han evaluado posibles factores de riesgo de cáncer en pacientes con Sc y, en consecuencia, posibles estrategias diagnósticas de prevención del cáncer en estos enfermos no han podido ser estudiadas.
Nuestro objetivo de estudio fue evaluar la frecuencia de cáncer en pacientes españoles con esclerodermia, seguidos en el Hospital General de Ciudad Real, y posibles factores de riesgo clínicos y/o serológicos asociados al desarrollo de cáncer en estos sujetos.
MATERIAL Y MÉTODOS.
Pacientes y método:
Realizamos un estudio observacional retrospectivo, incluyendo todos los pacientes con esclerodermia (esclerosis sistémica o esclerodermia localizada), seguidos en los servicios de Reumatología, Dermatología y Medicina Interna del Hospital General de Ciudad Real (HGCR), desde Enero de 1980 a Diciembre de 2010. El reclutamiento de los enfermos fue a través de los registros de cada servicio y del registro general del HGCR.
Los pacientes con esclerosis sistémica (SSc) fueron diagnosticados y clasificados de SSc con afectación dérmica difusa (dcSSc) o limitada (lcSSc), incluyendo la variante CREST (calcinosis, Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias), de acuerdo con los criterios propuestos por LeRoy et al7; y aquellos con esclerodermia localizada (lineal o morfea), por hallazgos clínicos e histopatológicos de la biopsia de piel afecta.
De la historia clínica de los enfermos se obtuvo un grupo de variables sociodemográficas (sexo, edad, tabaquismo); datos clínicos (afectación de órganos, esófago de Barret, diabetes mellitus/DM, hipertensión arterial/HTA, dislipemia) y de laboratorio (velocidad de sedimentación globular/VSG, proteína C reactiva/ PCR, proteinograma); autoanticuerpos presentes al inicio de la Sc (anticuerpos antinucleares/ANA, anticentrómero/ACA, anti-topoisomerasa I/Scl-70); tratamiento recibido para la Sc (esteroides sistémicos o tópicos, D-penicilamina, fármacos inmunosupresores); desarrollo de cáncer (tipo de tumor maligno, relación temporal con Sc, tratamiento tumoral); y evolución clínica de la esclerodermia. Esta última variable fue definida por la reducción o curación de las lesiones cutáneas, diminución de los reactantes de fase aguda (RFA), progresión de la enfermedad y muerte. El progreso de la esclerodermia fue valorado mediante la afectación de órganos internos secundarios a la enfermedad, basada en las siguientes pruebas complementarias: TC torácica de alta resolución, espirometría, ecocardiograma, esofagograma, análisis de laboratorio de la función de renal y, en casos seleccionados, biopsia renal.
El diagnóstico de cáncer fue establecido por análisis de marcadores tumorales, pruebas de imagen y/o estudio histopatológico de tejidos afectos. Los casos de malignidad fueron divididos en dos categorías, de acuerdo a su relación con el inicio de la esclerodermia: (1) diagnóstico de cáncer entre 6 meses antes y 12 meses después del debut de la enfermedad; (2) y más de 12 meses después del comienzo de la misma. El intervalo de tiempo para la definición de la categoría (1) fue elegido considerando el posible retraso en la identificación de cáncer, que podría haber estado presente antes del diagnóstico de esclerodermia y haber sido diagnosticado después (síndrome paraneoplásico)8.
Análisis estadístico:
Las características clínicas y demográficas de los pacientes fueron comparadas mediante la prueba de Chi-cuadrado o prueba exacta de Fisher, en caso de frecuencias esperadas menores de 5. La prueba T de Student fue empleada para el análisis de las variables cuantitativas del estudio, previa comprobación de la normalidad, y la U de Mann-Whitney, de no seguir una distribución normal.
El procesamiento de los datos fue realizado mediante el programa estadístico SPSS versión 18.0, y se consideraron significativos los valores de p < 0,05.
RESULTADOS.
Se identificaron 50 pacientes con esclerodermia entre Enero de 1980 a Diciembre de 2010, seguidos en los servicios de Reumatología, Dermatología y Medicina Interna del Hospital General de Ciudad Real (HGCR). Veinticuatro de los enfermos del estudio (48%) fueron diagnosticados de SSc y 26 (52%) con esclerodermia localizada. La edad media al diagnóstico de la enfermedad fue de 49±17 años. Las características clínicas y demográficas de los pacientes se muestran en la tabla I.
Tabla I: Características clínicas y demográficas de los pacientes con esclerodermia.
|
CARACTERÍSTICAS |
VALOR, N=50 |
|
Sexo:
|
36 (72%) 14 (28%)
|
Edad *:
|
48±17 49±17
|
|
Forma de esclerodermia: 1. Esclerosis sistémica (SSc): 1.1. Difusa (dcSSc) 1.2. Limitada (lcSSc) / CREST 2. Esclerodermia localizada: 2.1. Morfea 2.2. Esclerodermia lineal |
18 (36%) 6 (12%)
19 (38%) 7 (14%)
|
|
HTA |
20 (40%) |
|
Diabetes mellitus |
7 (14%) |
|
Hiperlipemia |
14 (28%) |
|
Tabaquismo |
8 (16%) |
|
Esófago de Barret |
3 (6%) |
|
VSG (mm/h) |
17 ± 17,69 |
|
PCR (mg/dl) |
0,87 ± 1,91 |
|
Consumo de complemento |
16 (32%) |
|
ANA positivos a |
25 (50%) |
|
ACA positivos a |
9 (18%) |
|
Anti-Scl-70 positivos a |
6 (12%) |
|
Proteinograma patológico |
8 (16%) |
|
Tratamiento con glucocorticoides:
|
14 (28%) 4 (8%) 12 (24%) |
|
Tratamiento con D-Penicilamina |
7 (14%) |
|
Tratamiento con inmunosupresores |
11 (22%) |
|
Fototerapia |
8 (16%) |
|
Reducción o curación de lesiones cutáneas |
10 (20%) |
|
Progresión de la enfermedad |
15 (30%) |
|
Muerte |
6 (12%) |
* Edad media respecto al género.
a Anticuerpos positivos al diagnóstico de la esclerodermia.
ANA: anticuerpos antinuclerares.
ACA: anticuerpos anticentrómero.
Anti-Scl-70: anticuerpos anti-topoisomerasa I.
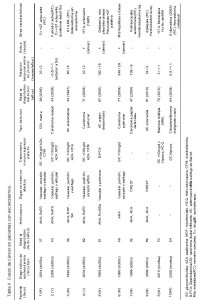
En nuestra cohorte, fueron diagnosticados 10 casos de cáncer (20%) en el período de estudio (8 SSc y 2 morfea). Los tipos de tumor maligno incluyeron cáncer de pulmón (n=2), mama (n=1), colon (n=1), endometrio (n=1), ovario (n=1), tiroides (n=1), vejiga (n=1), mieloma múltiple (n=1) y un adenocarcinoma de origen desconocido (tabla II). La edad media al diagnóstico de tumor maligno fue de 57±14 años. En relación al intervalo temporal entre inicio de esclerodermia y diagnóstico de tumor, 3 pacientes se identificaron en la categoría (1) y 7 en la categoría (2). Ninguno de los enfermos con cáncer estuvo expuesto a factores medioambientales (sílice, solventes orgánicos, bleomicina, L-triptófano u otros), antes del desarrollo del mismo.
Tabla II. Casos de cáncer en pacientes con esclerodermia. (pinchar sobre la imagen para aclarar y aumentar).
Tabla III: Análisis univariante del desarrollo de cáncer en pacientes con esclerodermia.
|
VARIABLE
|
Valor de P * |
| Género |
0,704 |
| Edad al inicio de la esclerodermia |
0,220 |
| VSG |
0,204 |
| PCR |
0,324 |
| Hipertensión arterial |
0,720 |
| Diabetes mellitus |
1 |
| Dislipemia |
0,246 |
| Tabaquismo |
0,041 |
| Anticuerpos antinucleares |
0,034 |
| Anticuerpos anticentrómero |
1 |
| ªAnticuerpos antitopoisomerasa |
0,086 |
| Progresión de la esclerodermia |
0,171 |
| D-Penicilamina |
0,616 |
| Inmunosupresores |
0,197 |
| Glucocorticoides |
1 |
| Muerte |
0,491 |
VSG: velocidad de sedimentación globular. PCR: proteína C reactiva.
P *: los valores de p<0,05 fueron considerados como significativos.
Variables que presentaron diferencias significativas con respecto al desarrollo de cáncer.
ª Variable con tendencia a la significación estadística.
En el análisis univariante, se objetivó que los niveles medios de VSG y PCR de los enfermos con esclerosis sistémica (al inicio de la enfermedad), fueron superiores a los del grupo de esclerodermia localizada, con una significación de p = 0,014 y p = 0,002 respectivamente. Así mismo, se detectaron diferencias significativas de estas variables con respecto a la progresión de la enfermedad, con niveles medios de las mismas superiores en el grupo de casos en los que progresó la enfermedad (p= 0,018 y p=0,027).
En relación a los parámetros inmunológicos, la proporción de consumo del complemento fue superior en el grupo de pacientes con esclerosis sistémica frente al grupo de enfermos con esclerodermia localizada, con una significación de p=0,001. Por otra parte, se detectaron diferencias significativas entre la positividad de los anticuerpos antinucleares (ANA), al diagnóstico de la esclerodermia, y desarrollo de tumor maligno (p=0,034), progresión de la enfermedad reumatológica (p=0,0001) y muerte (p=0,022). En el grupo de sujetos con ACA y anti-Scl-70 positivos al inicio de la esclerodermia, la proporción de pacientes con progresión de la enfermedad fue superior a la de aquellos que permanecieron estables (p=0,002 y p=0,032 respectivamente).
Todos los casos de muerte (n=6) cursaron con progresión de la esclerodermia y, en el 50% de estos, la causa de la misma fue la diseminación tumoral (p=0,002). Los enfermos restantes, dos fallecieron por insuficiencia cardíaca y otro por shock séptico de origen respiratorio. Sin embargo, las diferencias entre progresión de la esclerodermia y muerte con respecto a las terapias empleadas en el tratamiento de ésta, no fueron significativas.
El desarrollo de cáncer fue comparado con las variables edad al inicio de la Sc, VSG, PCR, DM, HTA, dislipemia, tabaquismo, autoanticuerpos (ANA, ACA, Scl-70), progresión y tratamiento de la Sc (D-penicilamina, inmunosupresores, esteroides) y muerte (tabla III). El 50% de los enfermos con hábito tabáquico desarrollaron cáncer. No obstante, en el grupo de pacientes con tumor maligno, el 60% eran no fumadores frente a un 40% que presentaban este hábito, con una significación de p=0,041. No se detectaron diferencias significativas entre el tratamiento del cáncer y la reducción o curación de las lesiones cutáneas, disminución de los RFA, progresión de la esclerodermia y muerte.
DISCUSIÓN.
En relación al objetivo principal del estudio, en nuestra cohorte se objetivó una elevada frecuencia de casos de cáncer en los pacientes con esclerodermia, seguidos en el Hospital General de Ciudad Real. La proporción de sujetos con SSc que desarrollaron un tumor maligno fue superior a la obtenida en otros estudios científicos publicados1,2,4-6,8. El tamaño muestral y las características de la población a estudio, pueden haber sido factores determinantes de estas diferencias, pues nuestra investigación es la primera en población española. La presencia de marcadores serológicos asociados al desarrollo de cáncer en pacientes con esclerodermia, fue el hallazgo más relevante en nuestro estudio.
Múltiples investigaciones científicas han demostrado que el riesgo de cáncer está incrementado en pacientes con esclerosis sistémica4-5,8-9,11-13,15. El tipo de tumor más frecuente en nuestra muestra fue el cáncer de pulmón, al igual que en otras cohortes europeas estudiadas, como la del estudio Olesen et al2. En la literatura publicada, los tipos de tumor más frecuentes en pacientes con esclerodermia son: pulmón, hematológicos, mama, piel y esófago2,5,7,15-18.
Airo’P et al exponen posibles causas de asociación entre estas dos enfermedades, como son: factores de riesgo en común (medioambientales14, tabaco, alcohol); exposición a agentes inmunosupresores; efectos de la inflamación crónica y fibrosis; y posibles genes implicados en ambas enfermedades1,2,11. En nuestra muestra, no se obtuvieron diferencias significativas en relación a presencia de tumor maligno y factores ambientales o terapias inmunosupresoras empleadas en el tratamiento de la esclerodermia. Esto sugiere que la propia patogenia de la enfermedad pueda condicionar un mayor riesgo en el desarrollo de neoplasia. En este contexto, los resultados de algunas publicaciones revelan que la esclerodermia es un factor de riesgo de cáncer2 e identifican marcadores genéticos y serológicos relacionados con manifestaciones más severas de la enfermedad1 y con el cáncer8. En nuestro análisis, objetivamos que la proporción de los marcadores inmunológicos positivos al diagnóstico de la esclerodermia (ANA, ACA y Scl-70), fue superior en el grupo de pacientes que cursaron con progresión de la enfermedad. El estudio de Gorlova et al1 identifica una asociación del gen NOTCH4 con la positividad de los anticuerpos anticentrómero y anticuerpos antitopoisomerasa I y, por otra parte, Hardie et al19 describen la implicación de este gen en las vías por las cuales el factor de necrosis tumoral β induce fibrosis pulmonar, una de las manifestaciones más graves de la esclerosis sistémica20-22. Los hallazgos de estos artículos científicos, justifican los resultados descritos en nuestra investigación.
Por otra parte, observamos diferencias significativas en el grupo de sujetos que desarrollaron cáncer con respecto a la positividad de los ANA, mas no en relación a los ACA y anti-Scl-70. Los anticuerpos anti-polimerasas del ARN tipo III (anti-RNAP III) son anticuerpos antinucleares, detectados en el 12-23% de los pacientes con esclerosis sistémica23, y se relacionan con un inicio rápido de la enfermedad y de la progresión de la afectación cutánea25. Shah et al26 han demostrado un incremento de antígenos nucleolares RNAP III en tejidos tumorales de pacientes con SSc y, en este contexto, sugieren que el cáncer podría iniciar una respuesta inmune especifica frente RNAP III, originando un inicio y progresión de la esclerosis sistémica más rápido en algunos pacientes. Así mismo, en un estudio de 360 italianos con SSc, el desarrollo de tumor maligno fue más frecuente en el grupo de pacientes con anti-RNAP III positivo que en los grupos con ACA y anti-Scl-70 positivo (p<0,001)8. Por tanto, la existencia de otros tipos de anticuerpos antinucleares, relacionados con la progresión de la esclerodermia y desarrollo de neoplasia maligna, podría explicar nuestros hallazgos, en relación a estos marcadores serológicos.
El tratamiento tumoral, de los casos de cáncer en nuestra cohorte, no influyó en la progresión de la esclerodermia. Si bien, el 40 % de los mismos no fueron tratados del proceso tumoral y, en consecuencia, pudo contribuir en la significación de las diferencias encontradas. Del mismo modo, no se pudo afirmar que los pacientes con esclerodermia incluidos en la categoría 1 (diagnóstico de cáncer entre 6 meses antes y 12 meses después del debut de la enfermedad), fuese de origen paraneoplásico.
En nuestro estudio, se nos plantearon importantes limitaciones derivadas del diseño retrospectivo y pequeño tamaño muestral (n=50) del mismo. Por otra parte, la no inclusión de detección de otros ANA (como el anti-RNAP III), en la batería de nuestro hospital, limitaron los resultados obtenidos. No obstante, los hallazgos objetivados en nuestra investigación fueron similares a los descritos en otros trabajos científicos publicados3,24.
En conclusión, nuestro estudio orienta, a la investigación futura, a la relación entre cáncer e inflamación en esclerodermia y, por otra parte, sugiere la necesidad de establecer medidas de prevención primaria y secundaria de cáncer en pacientes con esclerosis sistémica.
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA.
1. Gorlova O, Martin JE, Rueda B, Koeleman BP, Ying J, Teruel M, Diaz-Gallo LM, Broen JC, Vonk MC, Simeon CP, Alizadeh BZ, Coenen MJ, Voskuyl AE, Schuerwegh AJ, van Riel PL, Vanthuyne M, van ‘t Slot R, Italiaander A, Ophoff RA, Hunzelmann N, Fonollosa V, Ortego-Centeno N, González-Gay MA, García-Hernández FJ, González-Escribano MF, Airo P, van Laar J, Worthington J, Hesselstrand R, Smith V, de Keyser F, Houssiau F, Chee MM, Madhok R, Shiels PG, Westhovens R, Kreuter A, de Baere E, Witte T, Padyukov L, Nordin A, Scorza R, Lunardi C, Lie BA, Hoffmann-Vold AM, Palm O, García de la Peña P, Carreira P; Spanish Scleroderma Group, Varga J, Hinchcliff M, Lee AT, Gourh P, Amos CI, Wigley FM, Hummers LK, Nelson JL, Riemekasten G, Herrick A, Beretta L, Fonseca C, Denton CP, Gregersen PK, Agarwal S, Assassi S, Tan FK, Arnett FC, Radstake TR, Mayes MD, Martin J. Identification of novel genetic markers associated with clinical phenotypes of systemic sclerosis through a genome-wide association strategy. PLoS genetics 2011; 7(7):e1002178.
2. Olesen AB, Svaerke C, Farkas DK, Sørensen HT. Systemic sclerosis and the risk of cancer: a nationwide population-based cohort study. Br J Dermatol. 2010; 163(4):800-6.
3. Villaverde-Hueso A, Sánchez-Valle E, Alvarez E, Morant C, Carreira PE, Martín-Arribas MC, Gènova R, Ramírez-González A, de la Paz MP. Estimating the burden of scleroderma disease in Spain. J Rheumatol. 2007;34(11):2236-42.
4. Szekanecz É, Szamosi S, Horváth Á, Németh Á, Juhász B, Szántó J, Szücs G, Szekanecz Z. Malignancies associated with systemic sclerosis. Autoimmun Rev. 2012; 11(12):852-5.
5. Szekanecz Z, Szekanecz E, Bakó G, Shoenfeld Y. Malignancies in autoimmune rheumatic diseases – a mini-review. Gerontology. 2011; 57(1):3-10.
6. Hill CL, Nguyen AM, Roder D, Roberts-Thomson P. Risk of cancer in patients with scleroderma: a population based cohort study. Ann Rheum Dis 2003; 62:728-31.
7. Le Roy EC, Medsger TA Jr. Criteria for the classification of early systemic sclerosis. J Rheumatol 2001; 28:1573-6.
8. Airo’ P, Ceribelli A, Cavazzana I, Taraborelli M, Zingarelli S, Franceschini F. Malignancies in Italian patients with systemic sclerosis positive for anti-RNA polymerase III antibodies. J Rheumatol. 2011; 38(7):1329-34.
9. Wooten M. Systemic sclerosis and malignancy: a review of the literature. South Med J 2008; 101(1):59–62.
10. Derk CT, Rasheed M, Artlett CM, Jimenez SA. A cohort study of cancer incidence in systemic sclerosis. J Rheumatol 2006; 33(6):1113–6.
11. Rosenthal AK, McLaughlin JK, Gridley G et al. Incidence of cancer among patients with systemic sclerosis. Cancer 1995; 76:910–4.
12. Rosenthal AK, McLaughlin JK, Linet MS et al. Scleroderma and malignancy: an epidemiological study. Ann Rheum Dis 1993; 52:531–3.
13. Roumm AD, Medsger TA Jr. Cancer and systemic sclerosis. An epidemiologic study. Arthritis Rheum 1985; 28:1336–40.
14. Mora GF. Systemic sclerosis: environmental factors. J Rheumatol 2009; 36:2383-96.
15. Chatterjee S, Dombi GW, Severson RK, Mayes MD. Risk of malignancy in scleroderma: a population-based cohort study. Ann Rheum 2205; 52(8):2415-24.
16. Launay D, Le Berre R, Hatron PY et al. Association between systemic sclerosis and breast cancer: eight new cases and review of the literature. Clin Rheumatol 2004; 23:516–22.
17. Scope A, Sadetzki S, Sidi Y et al. Breast cancer and scleroderma. Skinmed 2006; 5:18–24.
18. Lee P, Alderdice C, Wilkinson S et al. Malignancy in progressive systemic sclerosis – association with breast carcinoma. J Rheumatol 1983;10:665–6.
19. Hardie WD, Korfhagen TR, Sartor MA, Prestridge A, Medvedovic M, et al. Genomic profile of matrix and vasculature remodeling in TGF-alpha induced pulmonary fibrosis. Am J Respir Cell Mol Biol 2007; 37: 309–21.
20. Silver RM, Miller KS, Kinsella MB, Smith EA, Schabel SI. Evaluation and management of scleroderma lung disease using bronchoalveolar lavage. Am J Med 1990; 88: 470–6.
21. Rubin LJ. Primary pulmonary hypertension. N Engl J Med 1997; 336: 111-7.
22. Ciołkiewicz M, Domysławska I, Ciołkiewicz A, Klimiuk PA, Kuryliszyn-Moskal A. Coexistence of systemic sclerosis, scleroderma-like syndromes and neoplastic diseases. Pol Arch Med Wewn 2008; 118(3):119-26.
23. Anticuerpos antinucleares. En: Rodriguez Mahou M, Sánchez-Ramón S, López Longo FJ. Autoanticuerpos de las enfermedades autoinmunes sistémicas. 1ªed. Majadahonda; Madrid: Ergon. 2012.p.37-74.
24. Siau K, Laversuch CJ, Creamer P, O’Rourke KP. Malignancy in scleroderma patients from south west England: a population-based cohort study. Rheumatol Int. 2011; 31(5):641-5.
25. Cavazzana I, Ceribelli A, Airo P, Zingarelli S, Tincani A, Franceschini F. Anti-RNA polymerase III antibodies: a marker of systemic sclerosis with rapid onset and skin thickening progression. Autoimmun Rev 2009; 8:580-4.
26. Shah AA, Rosen A, Hummers L, Wigley F, Casciola-Rosen I. Close temporal relationship between onset of cancer and scleroderma in patients with RNA polymerase I/III antibodies. Arthritis Rheum 2010; 62:2787-95.














Palabras Clave: anticuerpos antinucleares, cáncer, esclerodermia