AMILOIDOSIS SECUNDARIA A BRONQUIECTASIAS EN PACIENTE CON ANTECEDENTE DE TUBERCULOSIS PULMONAR
Fikri Benbrahim O.*, Rivera Hernández F.**, Sánchez de la Nieta García M.D:**, Murillo Lázaro C. ***, González López L.***.
* Servicio de Nefrología. Hospital La Mancha Centro. Alcázar de San Juan, Ciudad Real.
** Servicio de Nefrología. Hospital General de Ciudad Real.
*** Servicio de Anatomía Patológica. Hospital General de Ciudad Real.
Palabras claves: Amiloidosis AA; Tuberculosis pulmonar crónica; Bronquiectasias; Macrólidos.
Resumen: En el mundo occidental los cuadros de amiloidosis secundaria AA a una tuberculosis son poco frecuentes, pero algunos pacientes con lesiones pulmonares residuales o bronquiectasias son predispuestos a desarrollar una amiloidosis secundaria. Un tratamiento prolongado con macrólidos en determinados pacientes, diagnosticados de bronquiectasias, podría atenuar el estimulo inflamatorio persistente y reducir así el riesgo de desarrollar cuadros de amiloidosis AA con afectación renal. No obstante no existe un consenso generalizado, siendo recomendable individualizar cada caso, valorar los posibles efectos adversos y mayor riesgo de inducir una resistencia microbiana. Presentamos el caso de un paciente con diagnósticos de amiloidosis renal AA y bronquiectasias no candidato a un tratamiento preventivo con macrólidos que desarrollo posteriormente, un fracaso renal agudo en contexto de una sepsis de origen respiratoria.
Key words: AA amyloidosis; Chronic Pulmonary Tuberculosis; Bronchiectasis; Macrolides.
Abstract
AA amyloidosis secondary to tuberculosis is rare, but some patients with residual pulmonary lesions or bronchiectasis are predisposed to develop secondary amyloidosis. A prolonged treatment with macrolides in some patients diagnosed with bronchiectasis, could attenuate the persistent inflammatory stimulus and thus reduce the risk of developing renal AA amyloidosis. However there is no general consensus on the strategy to individualize every case, assess potential adverse effects and increased risk of inducing microbial resistance. We present the case of a patient with renal AA amyloidosis associated with bronchiectasis, who was not candidate for preventive treatment with macrolide that developed a acute renal failure in context of a respiratory sepsis.
INTRODUCCIÓN
La amiloidosis secundaria (AA) se caracteriza por depósitos extracelulares de proteínas fibrilares A derivadas de un precursor plasmático de síntesis hepática (reactante de fase aguda) que aumenta ante estímulos inflamatorios en relación con enfermedades infecciosas e inflamatorias crónicas (1). Los pacientes con tuberculosis pulmonar crónica (TBC) tienen un riesgo aumentado de desarrollar una amiloidosis AA ya que algunos se mantienen activos con lesiones residuales o quedan con bronquiectasias, ambas situaciones son estímulos amiloidogénicos (2). Presentamos el caso clínico de un paciente con diagnósticos previos de TBC y bronquiectasias que desarrolla un cuadro de amiloidosis renal AA y un posterior fracaso renal agudo en contexto de una sepsis de origen respiratoria.
PRESENTACION DEL CASO
Paciente varón de 40 años con antecedentes de TBC pulmonar bilateral e incumplimiento de tratamiento antituberculoso. En el año 2002, ingresó en UCI por cuadro de hemoptisis masiva y necesidad de ventilación mecánica. La evolución clínica fue posteriormente buena pero en controles radiológicos persistían secuelas de tuberculosis, bronquiectasias y signos de enfermedad pulmonar obstructiva crónica (EPOC) enfisematoso (figura 1). En enero de 2011 ingresó con cuadro de EPOC severo agudizado secundario a infección respiratoria y un síndrome nefrótico florido (proteinuria de 9-10 g/día, albúmina plasmática 1,9 g/dl, edemas generalizados en anasarca). Tras instaurar un tratamiento deplectivo con furosemida, evolucionó favorablemente pero persistía una proteinuria en rango nefrótico.
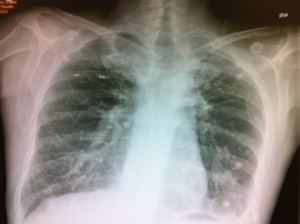
Figura 1: Radiografía simple de tórax donde se aprecian bronquiectasias en ambos lóbulos pulmonares.
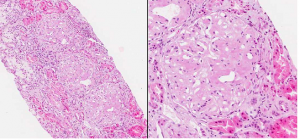
Se solicitó un estudio inmunológico que fue negativo al igual que el Mantoux y la serología vírica (VHB, VHC, HIV). Añadimos a su tratamiento IECA y ARA II para el control de la proteinuria y realizamos una biopsia de grasa subcutánea que reveló el diagnóstico de una amiloidosis AA que se confirmó mediante una biopsia renal (figura 2 y 3). Se estableció entonces el diagnóstico de una amiloidosis secundaria a secuelas de TBC y bronquiectasias.
A B
Figura 2: Biopsia renal. Tinción con hematosilina-eosina donde se evidencian depósitos amiloide en los mesangios de los glomérulos, obliterando las luces capilares (A y B).
C D
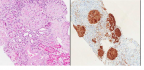
Figura 3: Biopsia renal. Se aprecian depósitos amiloides en un vaso (C). Mismo corte con Tinción inmunohistoquímica donde se ve depósitos amiloides en los vasos, además de los glomérulos (D).
Durante su seguimiento en consultas el paciente mantuvo una función renal estable con un filtrado glomerular alrededor de 60 ml/mn y una proteinuria elevada (alrededor de 5-6 gramos al día) acompañada de una hipoalbuminemia (2,1 g/dl). En varias ocasiones presento leves reagudizaciones de su EPOC secundarias a infecciones respiratorias sin filiar el germen responsable, pero con buena repuesta a antibióticos, aerosoles y corticoides orales. 2 meses después del ingreso el paciente sufre un fracaso renal agudo oligúrico en contexto de una sepsis grave de origen respiratorio. Requirió tratamiento renal sustitutivo transitorio mediante hemofiltración veno-venosa continua, ventilación respiratoria no invasiva, tratamiento antibiótico intravenoso de amplio espectro y corticoterapia intravenosa. Posteriormente la evolución clínica fue satisfactoria pero el paciente no recuperó su función renal basal, manteniendo al alta una creatinina de 4,5 mg/dl con diuresis conservada (en torno a 2000 ml/día). Se decidió entonces una actitud expectante ante la indicación de hemodiálisis convencional pero en menos de un mes el paciente tuvo una reagudización de su EPOC, reducción de su diuresis habitual, edemas generalizados y mayor deterioro renal siendo irreversible. Ante la evolución renal se decide incluirle definitivamente en programa de hemodiálisis convencional.
DISCUSION
La amiloidosis renal puede presentarse en forma de un síndrome nefrótico y cursar con una insuficiencia renal crónica (1,3) o rápidamente progresiva siendo menos frecuentes los cuadros de fracaso renal agudo y afectaciones túbulo-intersticiales aisladas (4). Los depósitos de amiloide se localizan en el glomérulo, en otras ocasiones predominan en vasos o túbulos cursando con disfunción tubular. Los principales factores pronósticos son los valores de albúmina, creatinina, niveles de amiloide sérico A (SAA) y proteinuria de 24h, incrementando la mortalidad principalmente por causas infecciosas y cardiovasculares. La monitorización de los niveles de SAA es un parámetro útil para el seguimiento de los pacientes, niveles elevados (superiores a 10 mg/l) se asocian a mayor mortalidad y peor función renal (1).
Actualmente en el mundo occidental los cuadros de amiloidosis secundaria a una tuberculosis son muy poco frecuentes, gracias a un mejor control de la enfermedad desde su debut, siendo los procesos reumatológicos, fundamentalmente la artritis reumatoide la principal causa de amiloidosis AA (1). Desgraciadamente la amiloidosis AA derivada de una TBC con afectación renal severa, en raras ocasiones modifica su curso clínico a pesar de instaurar un adecuado tratamiento antituberculoso (2). Aunque se han reportado algunos casos de síndrome nefrótico secundario a amiloidosis renal por tuberculosis que han remitido a los 48 meses, tras un año de tratamiento con tuberculostático (5). Costero y cols. describen el caso clínico de una paciente diagnosticada de amiloidosis renal secundaria a tuberculosis pulmonar que desarrolla un síndrome nefrótico en relación con infecciones respiratorias y que remite al curarse las mismas (6).
Las infecciones respiratorias recurrentes en pacientes diagnosticados de bronquiectasias son un potente estimulo para el desarrollo de amiloidosis. Son necesarias medidas preventivas, la vacunación antineumocócica e influenzae, fisioterapia respiratoria y un adecuado tratamiento antibiótico, evitando en lo posible inducir resistencias a los antibióticos, para disminuir la recurrencia de las infecciones (7). El mejor tratamiento en estos casos es tratar precozmente toda etiología infecciosa pulmonar para atenuar el estimulo inflamatorio persistente y reducir así el riesgo de desarrollar una amiloidosis AA con afectación renal (1,2).
Algunos autores aconsejan en estos pacientes, un tratamiento preventivo con macrólidos (7). La azitromicina a dosis de 500 mg, tres veces a la semana durante 6 meses podría disminuir la frecuencia de las exacerbaciones, aumentar la función pulmonar y mejorar la calidad de vida (8). Tras una única dosis de 500 mg, se alcanzan en el tejido pulmonar concentraciones inhibitorias mínimas del 90% (CIM90) para la mayoría de los gérmenes patógenos habituales (11). Los macrólidos además de poseer propiedades antibacteriana modulan la repuesta antiinflamatoria, disminuyendo la síntesis de interleucina (8), la migración de neutrófilos y aumentan la sensibilidad a los corticoides (7-9). Su principal inconveniente es le riesgo de inducir resistencias microbianas en particular por el Mycobacterium avium complex, además de sus efectos adversos (8-11). Debe contraindicarse su uso en pacientes con historial de hepatotoxicidad y hipersensibilidad asociada a un uso anterior, vigilar posibles reacciones de fotosensibilidad, alteraciones electrocardiograficas (prolongaciones del intervalo QT) y control periódico de los parámetros hepáticos (11). Además debemos de considerar las posibles interacciones farmacológicas entre ellas las más habituales, con el uso conjunto de anticoagulantes orales cumarínicos, digoxina, retrovirales, antiácidos y ergotamina (11). El principal objetivo, es evitar las exacerbaciones infecciosas atenuando el insulto inflamatorio y la carga bacteriana dentro de las vías respiratorias, pero antes debemos seleccionar a los pacientes candidatos a un tratamiento prolongado con macrólidos. Por ello disponemos de distintos marcadores inflamatorios y serológicos según la disponibilidad de cada centro hospitalario (12). Aunque en la práctica clínica la presencia de un esputo persistemente purulento y voluminoso al igual que un gran número de infecciones respiratorias anualmente, son condiciones suficientes para indicar un tratamiento crónico (8-10). Se aconseja suspender el tratamiento en ausencia de una repuesta tras un periodo de tres a seis meses, sino se objetiva una reducción de las exacerbaciones infecciosas o una mejoría en la calidad de vida en estos pacientes (9,10).
Hemos revisado otros casos publicados hasta la actualidad donde el tratamiento tuberculostático permitió una remisión tardía de un síndrome nefrótico secundario a una amiloidosis AA (5). Otros autores describen una paciente con amiloidosis AA y síndrome nefrótico, que fue diagnosticada y tratada de una tuberculosis pulmonar y a continuación recibió tratamiento con Tocilizumab, objetivando una exitosa resolución del síndrome nefrótico (13).
En nuestro caso las infecciones respiratorias recurrentes fueron un factor clave en la persistencia del síndrome nefrótico (6) en presencia de una amiloidosis AA secundaria a bronquiectasias. Hemos considerado la posibilidad de una profilaxis antibiótica con macrólidos pero se descartó esta opción terapéutica debido esencialmente al difícil cumplimiento terapéutico por parte del paciente. Optamos entonces por un control de la proteinuria mediante un doble bloqueo con ARA2 e IECAS aunque no obtuvimos una repuesta favorable lo que sugiere una afectación glomerular masiva por depósitos amiloide. Como hemos reseñado previamente los cuadros de fracasos renal agudo (FRA) secundarios a una amiloidosis son poco frecuentes pero estos pacientes pueden desarrollar un FRA de causa funcional o parenquimatosa en relación con etiologías infecciosas complicadas por una sepsis grave como fue el caso de nuestro paciente.
CONCLUSION
En pacientes diagnosticados de bronquiectasias con frecuentes infecciones respiratorias, podemos considerar la posibilidad de un tratamiento prolongado con macrólidos con el fin de evitar mayor recurrencia infecciosa. De este modo podemos atenuar el estimulo inflamatorio persistente y reducir el riesgo de desarrollar una amiloidosis secundaria. Hoy por día no existe un consenso generalizado sobre este tratamiento y es recomendable individualizar cada caso, valorar los posibles efectos adversos y riesgo de inducir una mayor resistencia microbiana.
BIBLIOGRAFIA
1. Torregrosa E, Hernández-Jaras J, Calvo C, Reus A, García-Pérez H, Maduell F, Vera JM. Amiloidosis secundaria (AA) y afectación renal. Nefrología 2003;23:321-6.
2. (4). Nik-Akhtar B, Khorsandi H, Nejatbaksh A. Incidence of renal amyloidosis in pulmonary tuberculosis. J Trop Med Hyg 1997;80(7):147-8.
3. (2) V. Esteve, J. Almirall, E. Ponz, N. García, L. Ribera, M. Larrosa, X. Andreu y M. García. Afectación renal en la amiloidosis. Características clínicas, evolución y supervivencia. Nefrología 2006;Vol. 26 (2):212-7.
4. (3) Ooms V, Decupere M, Lerut E, Vanrenterghem Y. Secondary renal amyloidosis due to long-standing tubulointerstitial nephritis in a patient with Sjögren syndrome. Am J Kidney Dis. 2005;46(5):75-80.
5. Castellano, J. R. Gómez-Martino, M.ª T. Hernández, R. Novillo y A. Covarsí. Remisión de síndrome nefrótico por amiloidosis renal secundaria a tuberculosis
pulmonar tras tratamiento tuberculostático. Nefrología 2001. Vol. 21(1): 88-91
6. O. Costero, C. Riñón, F. Gil, C. Díaz, C. Hevia, M. L. Picazo et al. Recurrencia y remisión espontánea de síndrome nefrótico en amiloidosis renal secundaria. Nefrología 2002.Vol. 22(5):482-4.
7. O’Donnell AE.Antimicrobial therapy for bronchiectasis. Clin Chest Med. 2012;33(2):381-6.
8. Wong C, Jayaram L, Karalus N, Eaton T, Tong C, Hockey H, Milne D et al. Azithromycin for prevention of exacerbations in non-cystic fibrosis bronchiectasis(EMBRACE): a randomised, double-blind, placebo-controlled trial. Lancet. 2012;380 (9842):660-7.
9. Feldman C. The use of antiinflammatory therapy and macrolides in bronchiectasis. Clin Chest Med. 2012;33(2):371-80.
10. Cameron EJ, McSharry C, Chaudhuri R, Farrow S, Thomson NC. Long-term macrolide treatment of chronic inflammatory airway diseases: risks, benefits and future developments. Clin Exp Allergy. 2012;42(9):1302-12.
11. Azitromicina. Ficha técnica. Agencia española de medicamento y productos sanitarios. (http://www.aemps.gob.es).
12. Smith MP, Hill AT. Evaluating success of therapy for bronchiectasis: what end points to use?Clin Chest Med. 2012;33(2):329-49.
13. Magro-Checa C and cols. Successful use of tocilizumab in a patient with nephrotic syndrome due to a rapidly progressing AA amyloidosis secondary to latent tuberculosis. Amyloid 2011;18(4):235-9.














Palabras Clave: Amiloidosis AA; Tuberculosis pulmonar crónica; Bronquiectasias; Macrólidos.