Papel del citrato combinado con el fluoruro sódico en la estabilidad de la glucemia en la fase preanalítica
Luis Sáenz-Mateos, Aurora Úrsula Muñoz-Colmenero, Carmen María Cabrera-Morales, Teodoro Javier Palomino-Muñoz, Amparo Sastre-Gómez, Pilar García-Chico-Sepúlveda. Servicio de Análisis Clínicos del Hospital General Universitario de Ciudad Real
RESUMEN:
Introducción
La pérdida pre-analítica de glucosa durante las primeras 1-2 horas después de la extracción constituye una gran fuente de error que interfiere tanto en el diagnóstico de diabetes como en el proceso de toma de decisiones clínicas en el manejo de los pacientes diabéticos. El tratamiento preanalítico estandarizado (i.e.: centrifugar las muestras en centrífugas refrigeradas y mantener el plasma, tras su pronta separación, en hielo picado) no es una solución adecuada para los 51 puntos de extracción periférica (PPOREs) de nuestra área. Una vez que ha sido probada que la acidificación de la sangre en tubos de fluoruro sódico inhibe rápidamente la glucólisis, nuestro objetivo es estudiar en nuestro entorno si los niveles de glucosa sanguínea en tubos de fluoruro-citrato se mantienen estables durante dos horas tras su extracción.
Material y Métodos
El estudio se realizó sobre 25 pacientes, seleccionados entre los que acuden a nuestra unidad de extracción. Dos tubos con heparina de litio y dos de fluoruro-citrato se extrajeron a cada paciente. Las parejas de tubos fueron almacenados durante una o dos horas en condiciones de transporte de muestras, previamente a su centrifugación y a la determinación de glucosa. Para la comparación de los niveles de glucosa se utilizó la t de Student de datos apareados.
Resultados
Los datos de la comparación mostraron que, en los tubos de heparina de litio, los niveles de glucosa tras una hora de almacenamiento eran en media aproximadamente 8 mg/dL superiores a los almacenados dos horas tras la extracción. (p<0.05). No se observaron diferencias significativas en los niveles de glucosa entre ambos tiempos de almacenamiento en los tubos con fluoruro-citrato.
Conclusiones
Concluimos que los tubos con fluoruro-citrato presentan una excelente alternativa al tratamiento preanalítico estandarizado, para estabilizar la glucosa durante las dos primeras horas.
KEYWORDS: citric acid; sodium fluoride; glucose; preanalytical; errors.
ABSTRACT
Introduction
The pre-analytical loss of glucose during the first 1-2 hours after collection constitutes a large source of error that interferes with both diabetes diagnosis and the process of clinical decision-making regarding management. The standardized pre-analytical processing (i.e.: centrifuging samples immediately in a refrigerated centrifuge and placing the removed plasma promptly into an ice slurry) is not a practical solution in our outpatient blood collection area composed of 51 blood collection facilities (PPOREs). As it has been reported that acidification of blood drawn into tubes containing sodium fluoride inhibits glycolysis quickly, our aim is to study in our setting whether glucose level in blood collected into tubes containing fluoride-citrate mixture is effectively preserved within two hours after collection.
Material and methods
The study was carried out from 25 selected outpatients coming to our blood collection unit. Venous blood was drawn into both two tubes prepared with lithium heparin and two tubes containing fluoride-citrate mixture. Pairs of tubes were stored under transport conditions for one or two hours and then centrifuged and analyzed for glucose. Paired Student’s t-test was used for glucose levels randomized comparison.
Results
Significance paired Student’s t-test revealed that glucose levels in tubes prepared with lithium heparin and stored one hour after collection were higher than those stored two hours after collection by approximately 8 mg/dl on average (p<0.05) . There was not statistically significant difference of glucose levels between both times as far as tubes prepared with fluoride-citrate mixture were concerned.
Conclusions
We conclude that drawing blood into tubes containing fluoride-citrate mixture to preserve glucose within two hours after collection is an excellent alternative for the standardized pre-analytical processing.
INTRODUCCIÓN:
El proceso del laboratorio clínico está estructurado en tres fases (preanalítica, analítica y postanalítica), formadas por un conjunto de pasos que se ven afectados por distintos errores.
La fase preanalítica consta de un conjunto de procesos difíciles de definir y acotar ya que se desarrollan en distintos espacios y en diferentes tiempos. Esta fase comprende aquellos procesos que tienen lugar desde la solicitud del análisis por parte del médico hasta que la muestra está lista para ser analizada, incluyendo la petición de las solicitudes, la preparación correcta del enfermo, la extracción u obtención de muestras, la identificación, el transporte, la recepción y la preparación de las muestras para su análisis1.
El transporte de especimenes desde los puntos periféricos de obtención y recepción de especímenes (PPOREs) hasta el hospital es una de las etapas críticas de la fase preanalítica; en los últimos años ha cobrado una gran relevancia al producirse una inevitable centralización de los análisis en grandes laboratorios, normalmente ubicados en los hospitales. Esta situación ha hecho necesario el desarrollo de normativas.
La normativa europea sobre el transporte por carretera ADR (Acuerdo Europeo sobre el transporte internacional de mercancías peligrosas por carretera) de 2009 considera las muestras biológicas como materias infecciosas de categoría B y define los requisitos de los embalajes para el transporte2. Por otro lado, la norma ISO 15189 señala que el laboratorio debe asegurarse que las muestras se transportan al laboratorio dentro de un intervalo de tiempo, temperatura y conservantes apropiados que aseguren la integridad de las muestras, garantizando la seguridad de todas las personas que participan en el transporte3. Ninguna de estas dos normativas especifica los límites de aceptabilidad de las variables tiempo y temperatura. Sin embargo, la guía del Clinical and Laboratory Standards Institute (CLSI) H18-A3 de 2004 recomienda un límite máximo de 2 horas para la centrifugación de muestras de suero o plasma4.
La glucosa es una magnitud biológica objeto de sufrir las condiciones anteriormente mencionadas en la fase preanalítica y por tanto podemos dar un resultado falso de sus niveles con consecuencias negativas tanto a nivel de paciente como a nivel epidemiológico introduciendo ruido5.
A temperatura ambiente, la glucosa se metaboliza a una velocidad aproximada de 7mg/dl/h, a 4ºC el índice de metabolización es menor y en presencia de contaminación bacteriana y leucocitosis este índice aumenta6. Para evitarlo se aconseja que el suero sea separado del coágulo dentro de las 2 horas posteriores a la extracción, en el caso del plasma, centrifugarlo y separarlo dentro de las 2 horas a partir del momento de la extracción y utilizar fluoruro sódico como aditivo para evitar la glucólisis.
La glucólisis es una vía química pH dependiente, el fluoruro sódico (NaF) es un aditivo que actúa inhibiendo el metabolismo celular a nivel de la enolasa, evitando la transformación de fosfoenolpiruvato en piruvato, incluso a pH bajo puede inhibir la incorporación de glucosa al reducir el gradiente de protones. Por estas razones, es considerado como un aditivo esencial para la determinación de la glucemia pero por si solo no previene el decrecimiento inicial de la glucosa. Las enzimas hexoquinasa y fosfofructoquinasa-1 activas en el inicio de la glucólisis poseen un pico de actividad óptimo a pH 8 no observándose actividad de las mismas a pH por debajo de 7. En esta etapa juega un papel importante el aditivo citrato/ácido cítrico, ya que actúa manteniendo el pH de la sangre a un nivel no fisiológico de 5.3-5.9 y por tanto inhibiendo a estas enzimas estabilizando los niveles de glucosa.
En base a estos datos, nos propusimos comprobar la estabilidad de la glucosa en tubos con fluoruro sódico combinados con citrato/ácido cítrico y tubos con heparina de litio simulando las condiciones de transporte de las muestras desde los PPOREs de nuestra área hasta el hospital durante 2 horas.
MATERIAL Y MÉTODOS:
El estudio se realizó sobre 25 pacientes, seleccionados, del punto de extracción, aleatoriamente y en un mismo periodo de tiempo.
A cada paciente se le extrajo cinco muestras de sangre para la determinación cuantitativa de glucosa. Los tubos diferían en el aditivo incorporado, dos contenían fluoruro sódico, citrato/ácido cítrico y EDTA+K2 (Terumo-Venosafe) y tres heparina de litio (Vacuette). Una de las muestras con heparina de litio fue inmediatamente centrifugada a 3200 rpm durante 10 minutos a su llegada al laboratorio y se determinaron niveles de glucosa en el plasma (glucosa a tiempo 0). Con el resto (dos tubos con fluoruro sódico + citrato y dos tubos con heparina de litio) se simularon las condiciones de transporte de muestras durante una hora (tiempo 1) y dos horas (tiempo 2), puntos en los que se procedió de la misma manera para determinar la glucosa que a tiempo 0.
El análisis de cada grupo de muestras se realizó a la vez para minimizar posibles variaciones analíticas, motivo por el cual la selección de pacientes se tuvo que llevar a cabo en un mismo periodo de tiempo.
La niveles de glucosa en plasma se cuantificaron en el analizador ADVIA® 2400 (ADVIA Chemistry Systems, SIEMENS). El método se basa en un ensayo enzimático, que utiliza las enzimas hexoquinasa y glucosa-6fosfato-deshidrogenasa. La glucosa es fosforilada por el trifosfato de adenosina (ATP) en presencia de hexocinasa. La glucosa-6-fosfato se oxida en presencia de gluosa-6-fosfato-deshidrogenasa, dando lugar a la reducción del NAD para formar NADH. Finalmente, la absorbancia del NADH se mide a 340nm como reacción de punto final.
El método de la hexoquinasa es específico para la medida de la glucosa y no presenta interferencias significativas con la bilirrubina, hemoglobina o triglicéridos hasta niveles elevados. El análisis presenta un rango analítico entre 0-700 mg/dL, con un coeficiente de variación (CV) del 1.5%.
Para la realización de los tests estadísticos se utilizó el paquete SPSS 11.0. Todas las variables se distribuían normalmente (test de Kolmogorov-Smirnov).
Una vez obtenidos los resultados se compararon los niveles de glucosa de los dos tipos de tubos a los distintos tiempos (1 h y 2 h) mediante el test T-Student para comparación de medias de datos apareados, con el fin de evaluar la estabilidad de la glucosa.
RESULTADOS:
El nivel de glucosa (mg/dL) disminuyó en 19 de las 25 muestras contenidas en los tubos con el aditivo de heparina de litio, después de una hora sin centrifugar simulando las condiciones del transporte de muestras al laboratorio. Tras dos horas con heparina de litio como aditivo el nivel de glucosa disminuye en 24 de los 25 tubos analizados.
En cambio, el nivel de glucosa en las muestras contenidas en los tubos con los aditivos fluoruro sódico y citrato solo disminuyó en 2 de los 25 tubos analizados tanto a la hora como a las dos horas.
En la figura 1 se han representado los niveles de glucosa de todas las muestras en los dos tipos de tubo y en los tiempos estudiados con respecto al nivel de glucosa basal. Se puede observar como la diferencia de glucosa con respecto a la basal, en valor absoluto, es mayor en todos los puntos que forman la línea correspondiente al tubo con heparina de litio tras una hora sin centrifugar (color rojo, DIF1HEP) que en cualquiera de las dos curvas correspondientes al tubo de fluoruro sódico y citrato (color azul DIF1FLU, tras una hora y rosa DIF2FLU, tras dos horas). Las diferencias son aún mayores en esos mismos tubos tras dos horas sin centrifugar (color verde, DIF2HEP) constatando el consumo de glucosa con respecto al tiempo con el aditivo de heparina de litio.
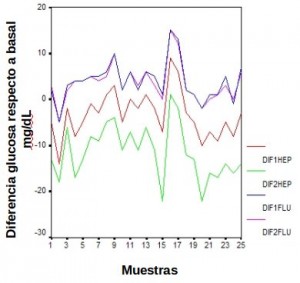
Figura 1. Representación de los niveles de glucosa con respecto a la basal en los distintos tubos en función del tiempo. DIF1FLU corresponde con la glucosa a la hora en tubo de fluoruro-citrato menos glucosa basal, DIF2FLU la glucosa a las dos horas en tubo de fluoruro-citrato menos glucosa basal, DIF1HEP la glucosa a la hora en tubo de heparina de litio menos glucosa basal y DIF2HEP la glucosa a las dos horas en tubo de heparina de litio menos glucosa basal.
Además, la diferencia de glucosa respecto a la basal en los tubos con fluoruro sódico y citrato, apenas varía entre la primera hora y la segunda hora sin centrifugar,como demuestra la superposición de las líneas azul y rosa a lo largo de todo el eje de abscisas (casos de la muestra) en la figura 1. Muy al contrario de lo que ocurre con los tubos de heparina de litio, dónde el espacio existente entre las líneas roja (DIF1HEP) y verde (DIF2HEP) a lo largo de todo el eje de abscisas nos revela una variación, elevada en relación a los tubos de fluoruro sódico y citrato, entre la primera y la segunda hora.
Se observan diferencias estadísticamente significativas entre los niveles de glucosa media a la hora (98,52 mg/dL de media con una SD de 19,62) y dos horas (90,44 mg/dL de media con una SD de 20,44) en los tubos con heparina de litio (P<0.05). No existen diferencias significativas en dichos niveles en los tubos de fluoruro sódico y citrato (105,8 mg/dL con SD 19,3 a la hora frente a 105,5 mg/dL con SD 18,95 a las dos horas).
Estos datos demuestran una gran estabilización de los niveles de glucosa enpresencia de fluoruro sódico y citrato a lo largo del tiempo (Figura 2).
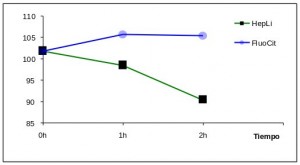
Figura 2. Representación de los niveles de glucosa media en función del tiempo. Se observa como los niveles de glucosa media se mantienen a lo largo de dos horas en los tubos con el aditivo fluoruro sódico + citrato (color azul) mientras disminuyen en los tubos con heparina de litio (color verde).
CONCLUSIONES:
Como ya comentamos en la introducción, la fase preanalítica se considera la fase más crítica del proceso del laboratorio clínico porque es en la que se produce un mayor número de errores.
La extracción y recogida de muestras no centrifugadas desde los PPOREs de nuestro entorno ha provocado que las muestras biológicas, se transporten y conserven en condiciones que pueden afectar a la estabilidad de las propiedades físico-químicas de sus componentes repercutiendo en la fiabilidad de los resultados. Se entiende por estabilidad de una magnitud bioquímica al periodo de tiempo en el que la magnitud mantiene su valor dentro de unos límites establecidos, conservando la muestra en la que se hace la medición en unas condiciones especificadas. Es importante destacar que la información suministrada por los laboratorios clínicos influye hasta en un 60-70 % en las decisiones clínicas, pudiendo dichas alteraciones influir en el diagnóstico y tratamiento de los pacientes.
Los niveles de glucemia son utilizados para diagnosticar la diabetes y para identificar pacientes con riesgo de desarrollar ciertas patologías como la diabetes gestacional o la retinopatía diabética5,7,8. Los laboratorios clínicos en la determinación de la glucemia, han perfeccionado la fase analítica con el uso de métodos enzimáticos y con analizadores sofisticados obteniendo niveles de imprecisión bajos con coeficientes de variación del 1%-2% en cuanto a métodos individuales y del 3% teniendo en cuenta todos los métodos analíticos9. Sin embargo, no se han hecho suficientes esfuerzos en este sentido en la fase preanalítica, donde los niveles de glucosa disminuyen, según diversos autores, entre un 5%-10% durante las primeras 2 horas tras la extracción de la muestra, fundamentalmente por el contacto de los hematíes con la sangre, debido al consumo de metabolitos por las células (glucosa, oxígeno) y por la difusión de líquido intracelular por el fallo de los sistemas de membrana10,11.
Las guías actuales para laboratorio clínico en el diagnóstico de la diabetes mellitus recomiendan que las concentraciones de glucosa deben ser medidas en suero o plasma separado de las células sanguíneas antes de una hora desde su extracción. Esta recomendación es muy difícil de cumplir para la mayoría de los laboratorios clínicos, puesto que en los PPOREs que se encuentren a cierta distancia habría que centrifugar en origen y transportar las muestras refrigeradas, por lo que se recomienda el uso del fluoruro sódico como aditivo de los tubos colectores para inhibir la glucólisis12.
El inconveniente del fluoruro sódico es que inhibe a la enzima enolasa, la cual se encuentra muy al final de la vía glucolítica10. Las enzimas que están por encima de la enolasa en esta vía, continúan activas y metabolizan la glucosa hasta agotar sus sustratos. La acción antiglucolítica del fluoruro no se produce hasta pasadas 4 horas13 lo que confirma que este aditivo por si solo no es un agente antiglucolítico efectivo14.
Existen trabajos que detallan como la acidificación precoz de la glucólisis es capaz de inhibirla11,15. La inhibición por acidificación ocurre a nivel de la hexoquinasa y la fosfofructoquinasa, enzimas que actúan muy al principio de la vía glucolítica (Figura 3). Tanto en plaquetas como en eritrocitos y leucocitos, la glucólisis es instantáneamente inhibida cuando el pH de la sangre se mantiene entre 5.3 y 5.9 por la acidificación del tampón citrato. Dicho efecto inhibidor es sostenible durante aproximadamente 10 horas a 25ºC 15,16.
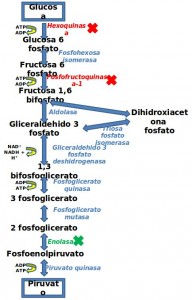
Figura 3. Inhibición de la glucólisis. En rojo al inicio de esta vía, el citrato/ácido cítrico actúa a nivel de las enzimas hexoquinasa y fosfofructoquinasa-1 descendiendo el pH a un nivel no fisiológico y evitando la actividad precoz de dichas enzimas. En verde vemos el nivel al que actúa el fluoruro sódico inhibiendo a la enzima enolasa evitando la transformación de fosfoenolpiruvato en piruvato, paso con el que finaliza esta vía catabólica.
En nuestro estudio simulamos las condiciones de transporte, durante dos horas, a las que son sometidas las muestras de sangre sin centrifugar transportadas desde los PPOREs hasta nuestro laboratorio.
Según nuestros resultados, se produce un descenso de la glucosa media en los tubos de heparina de litio de 3.36 mg/dL y 11.44 mg/dL tras 1 y 2 horas simulando las condiciones de transporte en las muestras sin centrifugar respectivamente. Es destacable que tras una hora se produzca un descenso de los niveles de glucosa en 19 de los 25 tubos y que tras dos horas ese descenso se produzca en 24 de los 25 tubos de heparina de litio. Según lo descrito en la literatura solo por la vía glucolítica en las muestras de sangre, la glucosa disminuye un 5%-7%/h para concentraciones cerca del intervalo de referencia5. En valores absolutos, muestras con 100 mg/dL de glucosa durante dos horas a temperatura ambiente puede producirse un descenso de hasta 12 mg/dL13. Por lo que estos datos están en consonancia con los resultados obtenidos en este estudio.
Sin embargo, en las muestras de sangre contenidas en los tubos con fluoruro sódico combinado con citrato, observamos que la disminución de los niveles de glucosa comparándola con la basal únicamente se produjo en 2 de 25 tubos tanto en la primera como en la segunda hora, constatando que la acidificación de la sangre a través del citrato inhibe la glucolisis en estadios precoces siendo reforzada tal inhibición por el efecto del fluoruro sódico a nivel celular11.
Resulta curioso que a pesar de la contundencia de los resultados obtenidos en varios estudios con esta mezcla de aditivos (algunos de ellos desde hace más de 20 años), en la actualidad no se utilicen de forma rutinaria en los laboratorios clínicos11,15,16.
Nuestro laboratorio tiene gran cantidad de rutas para dar servicio a 51 PPOREs de la provincia. Realizamos unas8800 determinaciones de glucosa mensuales de dichos centros. Dispone de un sistema de gestión de calidad conforme a la ISO 9001:200817, certificado desde mayo de 2010 por AENOR y en este contexto uno de nuestros indicadores de calidad preanalíticos para gestionar la mejora es el porcentaje de rutas de transporte de muestras periféricas que llegan antes de las 11 de la mañana; actualmente, un 80% de los transportes llegan antes de esa hora y a pesar del trabajo realizado en la mejora de este indicador es difícil conseguir un porcentaje superior, por tantomuchas de las muestras no son analizadas antes de que haya transcurrido 2 horas desde su extracción. Estos retrasos suelen ser inevitables y suponen un descenso significativo de la glucemia con consecuencias negativas para los pacientes como hemos descrito.
El procesamiento rápido de las muestras, su centrifugación refrigerada en tubos con gel separador y la utilización de hielo para su transporte por parte de los PPOREs estabilizaría los niveles de glucosa. Pero esta solución en nuestro ámbito no es viable debido al elevado número de muestras a procesar con celeridad, debido al coste que supondría dotar a cada PPORE de una centrífuga refrigerada y a la falta de contenedores con hielo que permitieran inhibir completamente el metabolismo de la glucosa.
Concluimos que en base a los resultados obtenidos en nuestro estudio, los tubos con fluoruro sódico y citrato presentan una excelente alternativa para evitar la glucólisis sin necesidad de centrifugación en el punto de extracción de la muestra. Y quizás podrían ayudar a evitar los falsos negativos de diabetes que se dan con los tubos de suero de gel separador de bioquímica y de plasma de heparina de litio que se usan de manera rutinaria en los envíos de las muestras a los laboratorios clínicos de los hospitales.
Es muy probable que el uso estandarizado de estos aditivos para el nivel de la glucemia ocasione una revisión al alza del punto de corte en el diagnóstico de la diabetes y otras patologías.
BIBLIOGRAFÍA:
1. NCCLS. Aplicación de un modelo de sistema de la calidad para los servicios de laboratorio; Guía aprobada-Segunda edición. NCCLS documento GP26-A2 (ISBN 1-56238-483-X). Wayne: Clinical and Laboratory Standards Institute; 2003.
2. ADR 2007. Acuerdo Europeo sobre el transporte internacional de mercancías peligrosas por carretera.
3. AENOR. Laboratorios clínicos. Requisitos particulares relativos a la calidad y la competencia. UNE-EN ISO 15189:2003. Madrid: AENOR 2003.
4. NCCLS. Procedures for the handling and processing of blood specimens; Approved guideline-Third edition. NCCLS document H18-A3. Wayne: Clinical and Laboratory Standards Institute; 2004.
5. Bruns DE, Knowler WC. Stabilization of glucose in blood samples: why it matters. Clin Chem. 2009;55(5):850-2.
6. Knudson PE, Weinstock RS, Henry JB. Hidratos de carbono. En: Davey FR, Herman CJ, McPherson RA, Pincus MR, Threatte GA, Woods GL, editores. Laboratorio en el diagnóstico clínico. New York: Marbán; 2010:211-23.
7. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: follow-up report on the diagnosis of diabetes mellitus. Diabetes Care 2003; 26:3160 –7.
8. Definition, diagnosis and classification of diabetes mellitus and its complications: report of a WHO consultation. Part 1: Diagnosis and classification of diabetes mellitus. Geneva: World Health Organization; 1999. 59 p.
9. C-C Chemistry/Therapeutic Drug Monitoring Survey 2008 CHM-11 to CHM-15 for glucose. Surveys 2008:18.
10. Mikesh LM, Bruns DE. Stabilization of glucose in blood specimens: mechanism of delay in fluoride inhibition of glycolysis [Letter]. Clin Chem 2008; 54:930 –2.
11. Gambino R, Piscitelli J, Ackattupathil TA, Theriault JL, Andrin RD, Sanfilippo ML, et al. Acidification of blood is superior to sodium fluoride alone as an inhibitor of glycolysis. Clin Chem. 2009 May;55(5):1019-21. Epub 2009 Mar 12.
12. Sacks DB, Bruns DE, Goldstein DE, Maclaren NK, McDonald JM, Parrott M. Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus. Clin Chem 2002;48:436 –72.
13. Chan AYW, Swaminanthan R, Cockram CS. Effectiveness of sodium fluoride as a preservative of glucose in blood. Clin Chem 1989;35:315–7.
14. Stahl M, Jørgensen LGM, Hyltoft Petersen P, Brandslund I, De Fine Olivarius N, Borch-Johnsen K. Optimization of preanalytical conditions and analysis of plasma glucose. 1. Impact of the new WHO and ADA recommendations on diagnosis of diabetes mellitus. Scan J Clin Lab Invest 2001;61:169–80.
15. Uchida K, Matuse R, Toyoda E, Okuda S, Tomita S. A new method of inhibiting glycolysis in blood samples. Clin Chim Acta 1988;172:101– 8.
16. Uchida K, Okuda S, Tanaka K, inventors; Terumo Corporation, assignee. Method of inhibiting glycolysis in blood samples. US patent 4,780,419. 1988 Oct 4.
17. AENOR. Sistemas de gestión de la calidad. Requisitos. UNE-EN ISO 9001:2008. Madrid: AENOR 2008.














Palabras Clave: ácido cítrico, errores, fluoruro sódico, glucosa, preanalítica