Cribado combinado en primer trimestre como método de detección de aneuploidías fetales
Maria Elena Fernández Fernández, Mª Ángeles Anaya Baz, Salvador Sedeño Rueda, Rosa Ana Garrido Esteban, Lucia Sánchez Hidalgo, Celia Pérez Parra. Servicio de Ginecología y Obstetricia. Hospital General Universitario de Ciudad Real.
Introducción: La prevalencia de aneuploidias ha aumentado en los últimos años siendo ésta una de las principales causas de morbimortalidad en la infancia. Existen diferentes métodos de cribado para su detección durante el primer trimestre de embarazo que se basan en combinar marcadores bioquímicos, ecográficos y clínicos. Estos métodos se orientan especialmente a la detección de Trisomía 21 por ser la más prevalente. En nuestro Servicio(Unidad de Diagnóstico Prenatal del Hospital General Universitario de Ciudad Real) utilizamos el test combinado en el primer trimestre. El objetivo de este trabajo es conocer la sensibilidad y el porcentaje de falsos positivos que obtenemos conla aplicación de este método.
Material y métodos: Se realiza un estudio descriptivo, retrospectivo, desde 1 de enero de 2009 hasta 31 de octubre de 2011 en el que se incluyen todas las gestantes a las que se realiza test combinado mediante determinación de la subunidad β libre de la gonadotropina coriónica humanay de la proteína A plasmática asociada al embarazo entre las semanas 9 y 10 y determinación de translucencia nucal y longitud cráneo-caudal en la semana 12. Se excluyen las gestaciones gemelares.
Resultados: Se analizaron 5192 test combinados. Un 94,57% (4910/5192) de las gestantes presentaron bajo riesgo y un 5,43% (282/5192) alto riesgo. En pacientes de alto riesgo se detectaron un 3,5% (10/282) de Trisomía 21, un 0,7% (2/282) de Trisomía 13, un 0,7% (2/282) de Trisomía 18 y un 0,7% (2/282) de Síndrome de Turner. La sensibilidad para T21 fue del 90%. La tasa de falsos positivos fue del 5%.
Conclusiones: La sensibilidad y la tasa de falsos positivos obtenidas con el método de cribado utilizado en nuestro centro son similares a las descritas en la literatura.
Key words: Chromosome disorders, Down syndrome, Prenatal diagnosis, Nuchal translucency measurement.
Introduction:The prevalenceofaneuploidyhas increasedin recent yearsand this is amajor causeof morbidity and mortalityin childhood. There are different screening methodsfor detectionduring the first trimesterof pregnancybased oncombiningbiochemical,clinicalandultrasound. These methods areespecially directedtothedetectionoftrisomy21 being the mostprevalent.Inour service(Prenatal Diagnosis Unit, Hospital General Universitario de Ciudad Real) used thefirsttrimestercombinedtest. The aim of thisstudy isto determinethe sensitivity andfalse positive ratewe obtain withthecombinedapplication of the test.
Materialand Methods: We performed a two years descriptive study. Combined test is performed on all women included in the study determiningfree β subunit human chorionic gonadotrophin and andpregnancy-associated plasma proteinbetween weeks9-10 andnuchal translucencyand fetal crown-rump lengthat week 12. Twin pregnanciesare excluded.
Results: There were 5192combinedtest. 94.57% (4910/5192)of pregnant womenhad lowrisk andhigh risk5.43% (282/5192). Inhigh-risk patientswere detected3.5% (10/282) ofTrisomy 21, 0,7% (2/282) of Trisomy 13, 0.7% (2/282) of Trisomy 18and 0.7% (2/282) of Sd. Turner. The sensitivity forT21was 90%. Thefalse positivewas 5%.
Conclusions:The sensitivity andfalse positive rateobtainedwiththe screening methodusedinourcentreare similarto those describedintheliterature.
INTRODUCCIÓN:
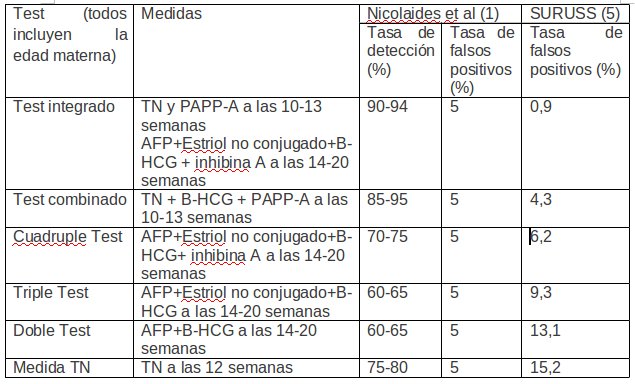
Las cromosomopatías son la principal causa de muerte perinatal y de minusvalía en la infancia. Se estima que en un 5% de las gestaciones se produce una anomalía cromosómica. La tasa de pérdida embrionaria o fetal en estas gestaciones es alta por lo que la prevalencia al nacimiento sería del 0,6% (1). Las cromosomopatías más frecuentes son las aneuploidias (trisomía 21 (T21), trisomía 18, trisomía 13, y sd. de Turner). En los últimos años se han desarrollado diferentes métodos de cribado orientados principalmente a la detección de la T21. Estos métodos combinan marcadores clínicos, ecográficos y bioquímicos y permiten obtener el riesgo de que una gestante sea portadora de un feto con T21. De esta forma se seleccionan pacientes de alto riesgo que pueden beneficiarse de una técnica de diagnóstico prenatal invasiva minimizando al máximo el porcentaje de pérdidas fetales asociado a estas técnicas, que se ha estimado en alrededor del 1 % (2,3). Existen varios métodos de cribado con diferentes tasas de detección (tabla 1). El método de cribado utilizado en nuestro Servicioes el test combinado de primer trimestre. Nuestro objetivo es conocer la sensibilidad y los falsos positivos obtenidos con este método y compararlos con los resultados descritos en la literatura, ya que la autoevaluación constante de cualquier programa de cribado es imprescindible para su correcto funcionamiento.
TABLA 1. Rendimiendo de diferentes métodos de cribado para trisomía 21
MATERIAL Y MÉTODO:
Se realiza un estudio descriptivo desde 1 de enero de 2009 hasta 31 de octubre de 2011. Se ofrece realizar cribado de cromosomopatías a todas las gestantes que acuden a consulta, excepto a aquellas con alguno de estos factores de riesgo: hijo previo con cromosomopatía documentada, progenitores portadores de una anomalía cromosómica equilibrada o historia familiar de enfermedad de transmisión monogénica con diagnóstico prenatal disponible, ya que en estos casos se oferta directamente una técnica de diagnóstico prenatal invasiva. Se incluyen en el estudio a todas aquellas mujeres que aceptan realizar un método de cribado. Se excluyen del estudio las gestaciones gemelares, ya que las tasas de detección de cromosomopatías son diferentes a las gestaciones únicas y por lo tanto deben estudiarse por separado. En todos los casos se ha informado del proceso y entregado un documento de consentimiento informado. Una vez aceptada la realización del cribado se realiza el test combinado en dos pasos: En primer lugar se procede a la determinación de los marcadores bioquímicos (subunidad βlibre de la Gonadotrofina Coriónica Humana (β-HCG) y Proteína A Plasmática asociada al embarazo (PAPP-A)) en sangre materna entre las semanas 9-10 de gestación. Posteriormente se realiza una ecografía en la semana 12 para obtener los marcadores ecográficos (longitud cráneo-caudal (LCC) y translucencia nucal (TN)). La determinación de PAPP-A y β-HCG en nuestro laboratorio cumple los estándares de calidad establecidos mediante el análisis periódico de los múltiplos de la mediana (MoM). Todas las ecografías se realizaronen un ecógrafo de alta resolución, por uno de los cuatro obstétras de la Unidad de Diagnóstico Prenatal. El tiempo de exploración asignado en la programación es de 20 minutos. La TN se mide siguiendo las pautas establecidas por la Fetal Medicine Foundation (www.fetalmedicine.com). Para calcular el índice de riesgo se combinan los marcadores bioquímicos y ecográficos descritos anteriormente ajustándolos mediante factores de corrección (peso materno, tabaquismo, grupo racial de la madre, gestación mediante técnicas de reproducción asistida y diabetes mellitusinsulinodependiente). Se define gestante de alto riesgo cuando el resultado es mayor o igual a 1/270 y bajo riesgo cuando es menor de 1/270. El punto de corte para determinar el riesgo ha sido consensuado en 1/270 en nuestro hospital, basándose en las recomendaciones de la Sociedad Española de Ginecología y Obstetricia (SEGO). Para la recogida de datos y cálculo de riesgo se empleó el Software PRISCA 4.0.15.9 DPC (Software for the risk calculation of Trisomy 21,Trisomy 18 and Neural Tube Defects). El análisis estadístico se ha realizado con SPSS V.15. La prueba diagnóstica de referencia utilizada para comparar los resultados del cribado combinado es el análisis del cariotipo tras una prueba de diagnóstico prenatal invasiva o bien la documentación de aneuploidía al nacimiento.
RESULTADOS:
Se atendieron 5389 pacientes en nuestra consulta en el periodo de estudio de las que 118 o bien no aceptaron la realización del cribado o bien cumplían directamente criterios para realizarse una prueba de diagnóstico prenatal invasiva. Se realizaron 5271 test combinados en el periodo de estudio lo que supone una cobertura del cribado que alcanza el 97,8% de las gestantes atendidas en nuestra consulta. El 1,4% de los estudios se realizaron en gestaciones gemelares lo que corresponde a 79 pacientes por lo que el total de las gestantes incluidas en nuestro estudio es de 5192. El rango de edad oscila entre 13 y 46 años, con una media de 31 años (Figura 1). Al analizar los factores de corrección utilizados en el cálculo del riesgo nos encontramos queel 21% (1090/5192) de las gestantes eran fumadoras, el 3% (155/5192) de las gestaciones fueron obtenidas por fecundación in vitro y el 7% (363/5192) de las gestantes estudiadas presentaban una diabetes pregestacional. El control de calidad de los marcadores bioquímicos utilizados para el cribado muestra que el nivel medio de PAPP-A en suero materno de nuestra población en la semana 9 es 0,97 MoM y en la semana 10 es 0,98 MoM y el nivel medio de b-HCG es 0,99 MoM en la semana 9 y 0,98 en la semana 10, cumpliendo de esta manera con los criterios de calidad requeridos. Se analizaron también los datos obtenidos de la medición de la translucencia nucal. La mediana de la TN en fetos euploides fue 1,3 y en fetos con trisomia 21 fue 2,3. La diferencia entre ambas poblaciones es estadísticamente significativa. Los resultados del cribado combinado fueron que el 94,57% (4910/5192) de las gestantes presentaban bajo riesgo y el 5,43% (282/5192) alto riesgo. El 37% (104/282) de pacientes con cribado combinado de alto riesgo deciden no realizar técnica invasiva de diagnóstico prenatal. En el total de pacientes con alto riesgo se detecta un 3,5% (10/282) de T21, un 0,7% (2/282) de T13, un 0,7% (2/282) de T18 y un 0,7%(2/282) de Sd. Turner. En el grupo de bajo riesgo se detectó al nacimiento una triploidia y una T21, tratándose ambos de falsos negativos del test. Se asume la posibilidad del nacimiento de un niño con aneuploidia fuera de nuestro centro y por lo tanto no documentada en este trabajo. La sensibilidad (tasa de detección) para T21 es del 90% y para T18 y T13 del 100%, con una tasa de falsos positivos para todos los casos del 5%. El hecho de obtener una sensibilidad del 100% en el caso de T18 y T13 probablemente se trate de un resultado sobreestimado debido al escaso número de casos de ambas aneuploidias. En la tabla 2 se puede ver la comparación de nuestros resultados con los resultados más relevantes obtenidos en la literatura.
|
Nicolaides et al (1) |
SURUSS(5) |
Fernández et al |
||
|
Test combinado |
Sensibilidad |
85-95% |
85% |
90% |
|
Falsos positivos |
5% |
4,3% |
5% |
|
Tabla 2: Comparación de los resultados de nuestros trabajo con los resultados publicados en la literatura.
DISCUSIÓN:
Se acepta que un cribado poblacional debe tener como mínimo una tasa de detección del 75% y una tasa de falsos positivos del 5%. Se han realizado numerosos estudios retrospectivos cuyo objetivo era determinar las tasas de detección y de falsos positivos de diferentes métodos de cribado (7,8,9,10,11,12,13,14,15,16,17), sus resultados están resumidos en la tabla 1. En 2003 se publicó el estudio multicéntrico de base poblacional SURUSS (FERUM Urine and Ultrasound Screening study) realizado en Reino Unido (4,5). Su objetivo era identificar el método de cribado más eficaz, seguro en cuanto a número de pérdidas fetales por cada 100000 gestantes cribadas y costo-efectivo. Concluye que el test integrado es el que consigue menor tasa de falsos positivos, mayor seguridad y mayor costo-eficiencia. Sin embargo es el que presenta mayor dificultad en su realización y por tanto en su implantación, ya que requiere que la paciente acepte realizarse una ecografía y no recibir información acerca del feto hasta la realización de la segunda prueba un mes después y realizar la interrupción del embarazo en el segundo trimestre en lugar de hacerlo en el primero. Si se omite el test integrado por sus dificultades, el test combinado del primer trimestre es el que mejor perfil de eficacia, seguridad y costo eficiencia presenta. A pesar de que el SURUSS es el estudio que aporta mayor evidencia sobre la efectividad de las estrategias de cribado de la T21, ha recibido algunas críticas derivadas del conflicto de intereses del autor principal (intereses comerciales en relación con patentes de software y marcadores como la inhibina A utilizado en el Test integrado). La Sociedad Española de Ginecología y Obstetricia (SEGO) recomienda realizar el cribado combinado del primer trimestre, que puede realizarse en un tiempo (valoración ecográfica y bioquímica el mismo día) o en dos tiempos (determinación bioquímica en semana 9-11 y ecografía entre 11-14). El cribado en dos pasos presenta mayor sensibilidad ya que la máxima rentabilidad de los marcadores se produce en momentos diferentes, semana 9-10 para marcadores bioquímicos y semana 12 para marcadores ecográficos. Para que la tasa de detección sea la adecuada es necesario un riguroso control de calidad y una auditoría de los datos utilizados en el cálculo de riesgo.
CONCLUSIÓN:
En nuestro Centro el análisis de los parámetros analíticos y ecográficos se adecúa a los estándares de calidad establecidos tanto por FetalTestcomo por la Fetal Medicine Foundation, permitiéndonos obtener una tasa de detección similar a las tasas descritas en la literatura.
BIBLIOGRAFÍA:
(1) Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn 2010;31:7-15.
(2) Tabor A, Madsen M, Obel EB, Philip J, Bang J, Norgaard-Pedersen B.
Randomised controlled trial of genetic amniocentesis in 4606 low-risk women.
Lancet 1986;1:1287-1293.
(3) Kuliev A, Jackson L, Froster U, Brambati B, Simpson JL, Verlinsky Y , et al. Chorionic villus sampling safety. Report of World Health Organization/EURO meeting in association with the Seventh International Conference on Early Prenatal Diagnosis of Genetic Diseases, Tel Aviv, Israel, May 21, 1994. Am J Obstet Gynecol 1996; 174(3):807-811.
(4) Wald NJ, Rodeck C, Hackshaw AK, et al. SURUSS Research Group. First and second trimester antenatal screening for Down´s syndrome:the results of the serum, urine and Ultrasound Screening Study (SURUSS). Health Technol Assess. 2003;7(11):1-77
(5) Wald NJ, Rodeck C, Hackshaw AK, Rudnicka A. SURUSS in perspective.
BJOG. 2004 Jun;111(6):521-531.
(6) Proyecto FetalTest. Sociedad Española de Ginecología y Obstetricia. www.fetaltest.com/cgi-bin/DOCUMENTOBASEFETALTEST.pdf
(7) Wald NJ, Cuckle HS, Densem JW, Nanchahal K, Royston P, Chard T, et al. Maternal serum screening for Down’s syndrome in early pregnancy. BMJ.1988 Oct 8;297(6653):883-887.
(8) Haddow JE, Palomaki GE, Knight GJ, Williams J, Pulkkinen A, Canick JA,
et al. Prenatal screening for Down’s syndrome with use of maternal serum markers. N Engl J Med. 1992 Aug 27;327(9):588-593.
(9) Wald NJ, Huttly WJ, Hackshaw AK. Antenatal screening for Down’s syndrome with the quadruple test. Lancet. 2003 Mar 8;361(9360):835-836.
(10) Schuchter K, Hafner E, Stangl G, Metzenbauer M, Hofinger D, Philipp K. The first trimester ‘combined test’ for the detection of Down syndrome pregnancies in 4939 unselected pregnancies. Prenat Diagn. 2002 Mar;22(3):211-215.
(11) Crossley JA, Aitken DA, Cameron AD, McBride E, Connor JM. Combined ultrasound and biochemical screening for Down’s syndrome in the first trimester: a Scottish multicentre study. BJOG. 2002 Jun;109(6):667-676.
(12) Spencer K, Spencer CE, Power M, Dawson C, Nicolaides KH. Screening for chromosomal abnormalities in the first trimester using ultrasound and maternal serum biochemistry in a one-stop clinic: a review of three years prospective experience. BJOG. 2003 Mar;110(3):281-286.
(13) Wapner R, Thom E, Simpson JL, Pergament E, Silver R, Filkins K, et al.
First Trimester Maternal Serum Biochemistry and Fetal Nuchal Translucency Screening (BUN) Study Group. First-trimester screening for trisomies 21 and 18. N Engl J Med. 2003 Oct 9;349(15):1405-1413.
(14) Wald NJ, Watt HC, Hackshaw AK. Integrated screening for Down’s syndrome on the basis of tests performed during the first and second trimesters. N Engl J Med. 1999 Aug 12;341(7):461-467.
(15) Cuckle H. Integrating antenatal Down’s syndrome screening. Curr Opin Obstet Gynecol. 2001 Apr;13(2):175-181.
(16) Wald NJ, Hackshaw AK. Advances in antenatal screening for Down syndrome. Baillieres Best Pract Res Clin Obstet Gynaecol. 2000 Aug;14(4):563-580.
(17) Audibert F, Dommergues M, Benattar C, Taieb J, Thalabard JC, Frydman R.Screening for Down syndrome using first-trimester ultrasound and secondtrimester maternal serum markers in a low-risk population: a prospective longitudinal study. Ultrasound Obstet Gynecol. 2001 Jul;18(1):26-31.














Palabras Clave: Cromosomopatía, Diagnóstico prenatal, Síndrome de Down, Translucencia nucal