¿Debe ser la biopsia del ganglio centinela el estandar de manejo actual en melanoma?
Guillermo Romero Aguilera* , Pilar Cortina de la Calle *, A. Alberto León Martín**. * Servicio de Dermatología HGUCR * * Unidad de Apoyo a la Investigación HGUCR
RESUMEN:
Objetivos: Evaluar la eficacia de labiopsia selectiva de ganglio centinela (BSGC) para el estadiaje, diagnóstico y tratamiento precoz de la enfermedad ganglionar metastásica por melanoma maligno
Estrategia de búsqueda: Bases de datos bibliográficas (Medline), Revistas científicas, webs científicas, fuentes propias.
Selección de estudios: Basada principalmente en la relevancia científica de las fuentes de información.
Resultados: Tras 20 años de andadura, la biopsia selectiva de ganglio centinela (BSGC) ha demostrado ser una herramienta muy eficaz para el estadiaje, diagnóstico y tratamiento precoz de la enfermedad ganglionar metastásica por melanoma maligno (MM). Por este motivo la técnica ha pasado de ser una innovación a un estándar práctico de manejo de amplio uso en la comunidad médica. Sin embargo la evidencia científica que justifica su uso suscita un encarnizado debate entre los expertos. Es aceptado que la BSGC es muy buen predictor de supervivencia enfermedad específica especialmente en melanomas de grosor intermedio y que en manos entrenadas tiene una morbilidad muy baja. Sin embargo ha fallado en demostrar su capacidad para modificar la supervivencia per se ni anticipando tratamientos quirúrgicos o adyuvantes. Por ello guías como EORTC o NCCN consideran más la BSGC como una técnica a ofrecer y discutir con los pacientes que un estándar de manejo indiscutible. Son muchas las áreas debatidas. Está en discusión si la reciente ampliación de los criterios de realización e interpretación de la BSGC aportan un claro beneficio en morbilidad y costes. Está por definir el significado biológico del concepto de micrometástasis y submicrometástasis, y no es claro que deba ser ampliado a depósitos ganglionares sin límite inferior.
Conclusiones: La necesidad de linfadenectomía completa tras positividad de la BSGC está en proceso de debate, y se precisan criterios histológicos firmes para definir la conducta a seguir. Para el estadiaje y seguimiento del MM estadíos I-II debieran explorarse otras vías pronósticas alternativas y/o complementarias a la BSGC como son el análisis histológico del tumor primario (linfangiogénesis) y técnicas de imagen.
INTRODUCCION:
La controversia:
En los años 70 el grupo de Morton y colaboradores en lo que denominan una aproximación racional al manejo quirúrgico del melanoma1 defendían la linfadenectomía electiva (LE) profiláctica del área de drenaje de todo MM con Breslow >1.5 o Clark mayor o igual a III. En 1977 comienzan a utilizar técnicas de linfoescintigrafía cutánea para identificar la cadena linfática de drenaje de melanoma maligno (MM) en áreas ambiguas (línea media en tronco u hombros). El mismo grupo en 1991 desarrolla la técnica de biopsia selectiva de ganglio centinela (BSGC)2 que ha demostrado ser muy eficaz en el estadiaje, diagnóstico y tratamiento precoz de la enfermedad ganglionar metastásica por MM3. Por ello en estos 20 años dicha técnica ha pasado de innovación a estándar práctico de manejo de amplio uso en la comunidad médica. Sin embargo la evidencia científica de mayor peso para justificar su uso 4 suscita un encarnizado debate entre los expertos, a favor 5-11 y en contra 12-21 de la misma. Este debate, de rabiosa actualidad 22, 23 en las revistas de máximo prestigio en dermatología y cirugía, debiera alertar sobre la conveniencia del uso habitual y sin restricciones de la técnica. Por este hecho y porque se cumplen dos décadas de su descripción parece un buen momento para reflexionar sobre la BSGC en MM 3.
En 2008 se publica en la revista española de dermatología, una gran revisión sobre ganglio centinela en MM 24 y un excelente artículo de opinión sobre su impacto en la supervivencia 25. Poco después se publica la nueva propuesta de clasificación del American Joint Committee on Cancer (AJCC) 26 basada en el análisis de la evolución de 38.918 melanomas. Un importante esfuerzo colaborativo multicéntrico que ha permitido recabar y analizar datos de seguimiento sobre un volumen de pacientes nunca antes alcanzado, y que por primera vez tiene datos de seguimiento a largo plazo de pacientes estratificados mediante BSGC. Las indicaciones se amplían 26 a todo MM de más de 1mm de Breslow y algunos subtipos de >0.75mm con factores de riesgo como presencia de ulceración o índice mitótico elevado. Consideran positivas BSGC con “agregados microscópicos con solo unas pocas células” detectadas por inmunohistoquímica (IHQ). No hay límite inferior y se cataloga como N1 un ganglio con un depósito tumoral de <0.1mm apareciendo un nuevo concepto, la submicrometástasis. Prácticamente los mismos autores de la guía de la AJCC, componentes de la “Sociedad Internacional del Ganglio Centinela” (con sus siglas en inglés ISNS), en un documento de consenso publicado también en 2009 10 recomiendan de forma unánime la linfadenectomía completa (LC) en todos los pacientes con BSGC positiva, incluyendo aquellos con submicrometástasis de un único ganglio. Esta actitud intervencionista es discutible y parece necesario ser más cauto y consensuar con los pacientes cada caso concreto16. Muchos expertos y guías como la australiana27, la Organización Europea para la Investigación y Tratamiento del Cancer (EORTC) 28 o la National Comprehensive Cancer Network (NCCN) 2011 defienden la actitud de ofrecer y discutir con el paciente la realización de la BSGC 16, 18, 19 antes que la indicación estandarizada.
SINTESIS DE RESULTADOS:
Sensibilidad y especificidad diagnóstica para la enfermedad ganglionar en MM: falsos positivos y falsos negativos en la BSGC.
Actualmente nadie duda de que el estatus de la BSGC sea un factor crucial en el estadiaje del melanoma23, 27 y se considerado el factor con mayor impacto predictivo de supervivencia en MM 3, 4, comparable al Breslow. La diseminación linfática es un proceso ordenado y definible, y la BSGC permite el diagnóstico precoz de la enfermedad ganglionar en MM. Ya en 1998 sobre 102 pacientes con BSGC positiva, la posterior linfadenectomía demostró enfermedad adicional ganglionar sólo en un 21% de pacientes 29, hecho confirmado en otras series4. Ello contrasta con el número de ganglios afectos en las linfadenectomías terapéuticas (LT) practicadas tras detección clínico-radiológica de la enfermedad ganglionar, los casos con un único ganglio afecto apenas alcanzan el 40% 30, 31.
La sensibilidad de la BSGC es del orden del 80% con un escaso 5% de falsos negativos. La realización simultánea de BSGC más linfadenectomía en todos los pacientes 32 sea la BSGC positiva o negativa, constata que un 5% (sobre unos 400 casos acumulados en varios trabajos) de BSGC negativa tiene enfermedad en otro ganglio de la cadena 3. Cifra congruente con las recidivas ganglionares (3-5%) que aparecen tras tres años de seguimiento en pacientes con BSGC negativas 33. Un falso negativo tendrá un pronóstico igual o peor que un verdadero positivo 34, lo que obliga a vigilar recurrencias ganglionares en pacientes con BSGC negativas.
En un estudio prospectivo a 10 años (1991-2001) sobre 1.375 BSGC exitosas las dos variables que independientemente predicen su positividad son Breslow y ulceración 35. Se trata de MM >1mm o menor con factores de riesgo, con una media de Breslow de 2.2mm, y un 16.9% de BSGC positivas. Los máximos predictores de positividad son el breslow con riesgo relativo (RR) de 2.4 y ulceración con RR 2.2, seguido de edad (<50 años RR 1.8) y localización (tronco RR 1.5).
El uso de IHQ minimiza el número de falsos negativos e incrementa los falsos positivos, perdiéndo homogeneidad pronóstica 34, 36. La última revisión de la AJCC 26 recomienda algún marcador (HMB-45, Melan-A, MART-1) en la detección de metástasis ganglionares a menos que el diagnóstico morfológico sea evidente. Consideran positivos depósitos celulares de melanoma de <0.1 mm si cumplen criterios histológicos de malignidad y los mencionados de marcaje inmunoquímico. Se amplia el concepto de micrometástasis de la edición previa 37 con un límite de 0.2mm pues en la nueva no hay límite inferior. Considera N1 la presencia de una submicrometástasis de menos de 0.1mm. Mantienen la diferencia entre IIIa de afectación microscópica detectada mediante BSGC (o micrometástasis) y IIIb (macrometástasis) detectadas por medios clínicos (palpación o estudios de imagen) o afectación grosera extracapsular histológica en un ganglio clínicamente oculto. El análisis de la nueva base de datos26 confirman algo conocido 38, la mayor carga tumoral en la afectación ganglionar, ya sea por diagnóstico clínico o radiológico de la misma (macrometástasis) o por un mayor número de ganglios afectos en la linfadenectomía, tiene lógicamente peor pronóstico. En esta gran serie 26 la supervivencia a cinco años varía en un rango entre el 78% para micrometástasis y el 40% en enfermedad macroscópica múltiple. Confirma la gran heterogeneidad pronóstica que ha existido siempre dentro de MM estadío III apuntando a que el manejo actual permite una mejora pronóstica respecto a los años 70-80, en que en una serie 31 de 1134 MM con afectación ganglionar (de 5111 MM tratados entre 1971-89) la supervivencia variaba entre 79% y 14% entre el mejor y el peor de los supuestos.
MM ganglionar y supervivencia
El valor pronóstico del estadiaje ganglionar en MM es conocido desde antiguo. La positividad en la LD triplica la mortalidad 38 y la carga tumoral es crucial, con supervivencia libre de enfermedad a 5 años de 41%, 30% y 18% para la presencia de 1, 2 y 3 ó más ganglios afectos. La agresividad es mayor en metástasis síncronas o en primer año de evolución con supervivencia media 22 meses frente a 44 meses en las detectadas después de un año de diagnóstico 38. Estudios recientes confirman estos datos 36 y sugieren que la biología del tumor y su agresividad es proporcional a la precocidad de la afectación ganglionar y a la propia carga tumoral ganglionar. Comparando datos antiguos 38 y actuales 26, 36 la supervivencia de MM está sufriendo un incremento progresivo que palia el concomitante incremento de la incidencia. La supervivencia global del MM a 5 años en USA está por encima del 90%, por lo que también puede que cada vez resulte más costoso mejorar esta cifra http://seer.cancer.gov/faststats/selections.php?series=cancer
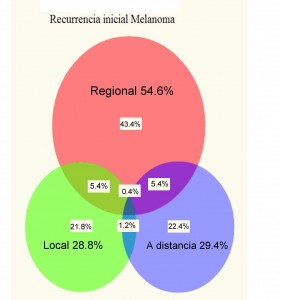
Figura 1 DIAGRAMA de VENN: recurrencias iniciales (N= 1.085) por sitio de recurrencia sobre 4.568 MM localizados: ganglionares-rojo 54.6%, a distancia-azul 29.4% y locales-verde 28.8% (datos tomados de Soong et al ref 39).
Las grandes series de finales de los 90 demuestran que entre un 25 y un 33% de los MM estadíos I-II tendrán recidivas, de ellas más de la mitad de las recurrencias iniciales serán ganglionares, 29 % a distancia y 28% locales 39 (Figura 1). El solapamiento de diferentes vías de recurrencia ocurre en un 12% de pacientes, y no llega al 20% de pacientes con metástasis viscerales que tengan enfermedad ganglionar concomitante de inicio. La mitad de las recurrencias ocurren en los primeros 2 años, y el 85% antes de 5 años, periodo en que la vigilancia debe extremarse y pero debe continuarse por 10-15 años pues existen recurrencias tardías (Figura 2). Los resultados son superponibles a otra serie de 3258 MM 40 con un 8% de metástasis síncronas, y un 15% adicional en los 3001 MM estadíos I-II iniciales que se hacen metastáticos. Las recurrencias iniciales el 50% son ganglionares, 28% a distancia y 21% locales. La serie europea reporta la evolución, de 20 años entre 1976 y 1996, y constatan que en la mitad de los pacientes con recurrencias regionales y locales aparecerán metástasis a distancia. En esta serie el 41% de las metástasis a distancia aparecen de novo, el 43% en la evolución de enfermedad regional, y 16% tras la presencia de satelitosis. De forma elocuente la demora para la aparición de las metástasis a distancia es similar (entre 24-30 meses tras diagnóstico del primario) independientemente de la vía inicial de recurrencia. Estos datos apoyan la denominada hipótesis del marcador, defendida por Ackermann41, que sostiene que la diseminación ganglionar y visceral es simultánea, no secuencial como defiende Morton. La presencia de enfermedad ganglionar, más si es precoz, síncrona, múltiple, o en definitiva agresiva, es un marcador de probable diseminación visceral simultánea.
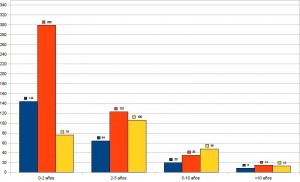
Figura 2 Tabla de frecuencias: Primeras recurrencias (N=1.085) por sitio y momento de recurrencia sobre 4.568 MM localizados seguidos por una media de 5.3 años en dos centros de USA y Australia (datos tomados de Soong et al ref 39).
Lo que acaba con la vida del paciente son esas metástasis a distancia 40, y eso nos lleva al gran debate. ¿La resección precoz de una cadena ganglionar afecta de MM mejora la supervivencia? Han pasado más de 100 años desde que en 1892 el Dr Snow 20 planteara la linfadenectomía preventiva para mejorar la supervivencia en MM. No hemos contado con resultados de ensayos clínicos aleatorizados (ECA) hasta casi el 2000 42, 43. Estos resultados son desalentadores la linfadenectomía completa (LC) de la enfermedad ganglionar detectada precozmente por BSGC no mejora de forma notoria la supervivencia 34. La diseminación a distancia secuencial desde el ganglio propiciada por mutaciones adicionales en células quiescentes es un fenómeno posible pero no demostrado. Si existe es poco común, difícil de demostrar, explicando la escasa ventaja de supervivenvia que aportan la LE o la LSC .
El MM ganglionar en los 80: La linfadenectomía preventiva o electiva (LE)
El manejo de la enfermedad ganglionar subclínica fue evaluado en ECA a partir de los años 80 y lógicamente sus resultados de supervivencia no se publicaron hasta finales de los 90 42, 43. Estos estudios comparan un grupo de escisión amplia del MM primario más linfadenectomía electiva (LE) a pesar de no afectación ganglionar clínicamente aparente frente a un segundo grupo de escisión amplia del primario más observación y linfadenectomía terapéutica (LT) sólo en caso de recidiva ganglionar. No se encontraron ventajas significativas de supervivencia global al practicar LE frente a la LT. Se observaron tendencias a las ventajas de supervivencia a 5 años en los grupos de LE sin alcanzar significación estadística, con p entre 0.09 y 0.11 3. Podría tratarse de un error beta pues la diferencia entre grupos es escasa y podría ser necesario un tamaño muestral mayor para demostrarla. Es decir, faltaría potencia a los estudios para alcanzar significación estadística. De hecho hubo subgrupos de pacientes en el brazo de LE que si alcanzaron dicha significación para mejoría en la supervivencia, en concreto los MM 1-2mm y los no ulcerados en el primer estudio 42 y los MM de tronco de >1.5mm con metástasis microscópicas en el segundo 43, siempre frente a los grupos en los que la aleatorización indicaba una actitud de simple vigilancia de la posible aparición de enfermedad ganglionar.
Un metanálisis previo44 ya alertaba que la LE no incrementaba la supervivencia en MM, aunque en el subgrupo de MM de espesor intermedio (1-4mm) podría ser de beneficio. Otro trabajo en la misma época constata que los pacientes con MM eran manejados desde perspectivas opuestas, una intervencionista en USA y Australia proclive a la LE en MM intermedios, y otra expectante en Europa45. Sin embargo ya en ese momento la mayoría de opiniones basadas en grandes series de pacientes con MM manejados mediante LE 43, 46, 47 son contrarias a su realización pues no encuentran beneficio alguno. Piepkorn et al 48 zanjan la polémica en un esclarecedor y premonitorio artículo donde destacan que los ECA no encuentran beneficio de supervivencia para la LE, que las escasas ventajas detectadas en los estudios no aleatorizados tienen sesgos de selección evidentes, y se basan en análisis de subgrupos postaleatorización que son metodológicamente incorrectos. Como veremos este error se repetirá en el futuro. En este momento, 1997, los autores conceden un papel de estadiaje pronóstico y no terapéutico a la BSGC, más justificable en el seno de ensayos clínicos.
La época de la BSGC y el MSLT-I: la linfadenectomia selectiva completa (LSC)
Tras la aparición de la BSGC se publican una serie de estudios retrospectivos comparando pacientes evaluados mediante BSGC y linfadenectomía completa inmediata en caso de positividad de la técnica (linfadenectomía selectiva completa o LSC) frente a pacientes “antiguos” de la etapa pre-BSGC sometidos a simple observación y LT en caso de recidiva ganglionar. Estos estudios tuvieron resultados contradictorios que apuntaban a que pudiera existir una ventaja de supervivencia en el grupo de BSGC que afectara a un grupo menor dentro del total de pacientes siendo por tanto difícil de detectar 49. En cualquier caso no parece lógico que la LSC aumente la supervivencia si no lo hace la LE, especialmente en zonas donde el área ganlionar de drenaje es evidente, como los miembros.
a) Diseño y resultados en el MSLT-I: la importancia de los falsos positivos.
El MSLT I (Multicenter Selective Lymphadenectomy Trial-1) es el estudio de mayor calidad metodológica para responder a la cuestión de si el diagnóstico precoz de la enfermedad ganglionar mediante BSGC mejora la supervivencia en MM 4 pues la plantea de forma aleatorizada y prospectiva. Los pacientes con MM cutáneo primario fueron asignados aleatoriamente a escisión amplia del primario y observación postoperatoria de los ganglios linfáticos regionales con linfadenectomía en caso de recidiva ganglionar (LT) versus escisión amplia y biopsia de ganglio centinela con linfadenectomía selectiva (LSC) inmediata si se detectaban micrometástasis ganglionares en la biopsia. Entre febrero 1994 y marzo 2002 se reclutaron 2001 MM, aleatorizados (60/40) a realización de BSGC vs simple observación. Contamos con los datos del tercer análisis interino de los 5 planeados4, y solo los correspondientes a los 1347 pacientes con MM de grosor intermedio (1.2-3.5mm) pues los autores de forma arbitraria no presentaron los datos del resto de grupos lo que ha sido criticado 17, 50. El dato crucial del estudio fue negativo pues no hay diferencias de supervivencia melanoma-específica a 5 años entre los dos grupos (87.1 grupo BSGC vs 86.6% grupo observación; p=0.59) con una media de seguimiento de 59.8 meses. Este dato es incontestable, la ventaja de supervivencia entre los dos grupos es muy pequeña o no existe.
La incidencia de metástasis ganglionar en el grupo de BSGC fue del 16% similar al 15.6% de recidivas ganglionares del grupo de observación. Sin embargo el 3.4% de falsos negativos del grupo de BSGC, es decir, las recurrencias ganglionares que aparecieron tiempo después en pacientes con BSGC negativa, supone un total de 19.4% de enfermedad ganglionar en el brazo de BSGC frente al 15.6% del brazo de observación. Podríamos deducir 14, 5121 que un 24% de pacientes del grupo de BSGC son falsos positivos, es decir, la BSGC sobrediagnostica la enfermedad ganglionar. Casi uno de cada 4 pacientes con BSGC positiva podría no desarrollar enfermedad ganglionar clínica dejada a su propia evolución 14, 52. Tal como sostiene el Dr Pizarro 25 fenómenos de quiescencia o senescencia tumoral explicarían los falsos positivos y por qué puede existir un falso incremento de la supervivencia en el grupo de pacientes con micrometástasis detectadas con BSGC. El propio Morton intenta explicar este fenómeno de falsos positivos y minimizarlo aplicando una corrección de Kaplan-Meier que tenga en cuenta recurrencias ganglionares tardías y las pérdidas en ambos grupos7. Sin embargo la presentación de datos del 4º análisis interino del MSLT I 7, 53 apunta a que el ritmo de recurrencias tardías se enlentece en el tiempo haciendo casi imposible54 que para el 5º y definitivo análisis las recurrencias ganglionares en el grupo observación alcancen a las del grupo de BSGC. Es decir hay más enfermedad ganglionar en el grupo de BSGC porque detecta falsos positivos. La presencia de células durmientes es un hecho constatado en BSGC realizadas 3 años después de la extirpación del primario 55. Estas células pudieran ser falsos positivos o posibilitar recurrencias tardías.
b) EL MSLT-I : un eficaz diagnóstico y tratamiento precoz de la enfermedad ganglionar no mejora la supervivencia
El MSLT-I demuestra que la BSGC no mejora la supervivencia en MM pero si es una buena herramienta para el diagnóstico y tratamiento precoz de la enfermedad ganglionar. De hecho hay menor número de ganglios afectos en las LSC del grupo con BSGC positiva que en las LT de las recidivas ganglionares del grupo observación (1.4 vs 3.3 ganglios afectos, p<0.001). No solo eso, en el 84% de las LSC no se encuentra ya ningún ganglio afecto. El tratamiento de la enfermedad ganglionar es también eficaz puesto que las recurrencias ganglionares serán excepcionales (<5%) tras LSC 23.
Los autores realizan un subanálisis de la supervivencia específica de enfermedad a 5 años en el subgrupo de pacientes con enfermedad ganglionar que ha sido muy criticado 13, 15, 20 y que recuerda los subanálisis que ya criticaba Piepkorn 48 en 1997. En el grupo de pacientes con enfermedad ganglionar detectada por BSGC respecto a la detectada por observación clínico-radiológica Morton et al 4 observan una ventaja de supervivencia del 20% (72.3 ±4.6% vs 52.4 ±5.9%; hazard ratio para mortalidad 0.51, 95% IC 0.32-0.81; p=0.004). Parecería lógico que si una metástasis ganglionar microscópica no detectable clínicamente se deja crecer hasta que lo es pueda tener peor pronóstico por la posibilidad de metástasis a distancia y el propio incremento de la carga tumoral que supone esta espera frente a la detección y linfadenectomía precoz realizada en pacientes con BSGC positiva 9. Los recientes datos de mayor supervivencia de pacientes con micrometástasis frente a las macrometástasis de la base de datos de la AJCC 26 apoyarían esta teoría si obviáramos el fenómeno de los falsos positivos.
Sin embargo esta comparación de subgrupos postaleatorización no se sostiene desde el punto de vista metodológico. La aleatorización es la característica que confiere a los estudios experimentales gran parte de su capacidad demostrativa. No podemos olvidar que al asignar al azar a los participantes de un estudio a 2 grupos, sobre todo si la muestra es numerosa, se tiende a conseguir una distribución homogénea de los principales predictores de la variable a estudio (en este caso mortalidad). Gracias a esa aleatorización podemos asumir que si al final del estudio existen diferencias en los 2 grupos en la frecuencia de esta variable, ésta se debe exclusivamente a la exposición a estudio (ganglio centinela frente observación) y no a otros factores postaleatorización que ya no controlamos. Si analizamos, como es el caso, 2 grupos después de la aleatorización en ningún caso podemos asegurar una distribución similar de los predictores de la variable de resultado56. El subanálisis del estudio de Morton es metodológicamente incorrecto13, 52, 54. Es cierto que no hay un sesgo del momento del diagnóstico (lead time bias) puesto que la supervivencia se mide a raíz del diagnóstico del MM primario, no del momento de la afectación ganglionar. Existe sin embargo muy probablemente un sesgo de clasificación pues el grupo de BSGC tiene una enfermedad ganglionar precoz, más frecuentemente microscópica con menor número de ganglios afectos que el grupo de vigilancia donde se hace un diagnóstico clínico más tardío con mayor carga tumoral. La BSGC puede identificar pacientes de mejor pronóstico con enfermedad ganglionar menos agresiva. Este efecto puede deberse no solo a la propia intervención (detección precoz mediante ganglio centinela), lo cuál sería metodológicamente impecable sino que en el grupo de BSGC hay probablemente pacientes con enfermedad microscópica biológicamente menos agresiva 25, 52, 54 que finalmente no habría progresado de haberse dejado a la simple observación. Este porcentaje ya comentado de falsos positivos daría una ventaja de supervivencia irreal no debida a la linfadenectomía precoz sino al sobrediagnóstico de la enfermedad ganglionar en el grupo de BSGC.
Por otro lado el propio diseño del MSLT-I impide el análisis de la supervivencia libre de enfermedad20, 54, lógicamente si detectamos y tratamos precozmente la enfermedad ganglionar mediante LSC habrá menos recurrencias ganglionares en el brazo de BSGC. Con este diseño no se pueden hacer comparaciones sobre supervivencia libre de enfermedad que incluya la enfermedad ganglionar como un resultado final a medir. Lo que hace la BSGC es anticipar el diagnóstico y tratar precozmente la enfermedad ganglionar pero no mejorar el pronóstico16. Este sólo mejoraría si la BSGC y LSC condicionara una mayor supervivencia libre de metástasis a distancia54, algo que no parece conseguir. Lo que incrementa la BSGC es la supervivencia libre de enfermedad ganglionar porque es tratada precozmente por LSC. La LSC no ha demostrado aumentar la supervivencia como tampoco lo hizo la LE.
c) El MSLT-I: la potencia estadística resulta insuficiente.
La potencia estadística depende en gran medida de 2 factores. El primero es el tamaño del efecto a detectar, es decir, la magnitud de la diferencia o asociación entre los grupos. Cuanto menor es la magnitud del efecto, menor será la probabilidad de detectar diferencias significativas, y por ende, menor será la potencia estadística. Si la diferencia es pequeña será difícil de detectar. El segundo factor es el tamaño muestral. La potencia estadística aumenta a medida que lo hace el número de sujetos a estudio 57. Lo que nos dice el MSLT I es que si existe una ventaja de supervivencia por practicar LSC precoces previa BSGC esta ventaja es realmente muy pequeña. Por tanto el tamaño muestral necesario para encontrar diferencias es muy elevado. Se explica teniendo en cuenta 25 que la linfadenectomía terapéutica diferida practicada en el grupo de no intervención también curaría un 30% de los pacientes aunque se realice de forma tardía 39 y que en el diseño existe un 84% de pacientes sin enfermedad ganglionar que diluyen el efecto. Si obviamos el fenómeno de los falsos positivos y se da por cierta una ventaja de supervivencia del 20% en los pacientes con enfermedad ganglionar (que serían un 16% del total) habría que esperar un incremento de supervivencia en el global de MM inicialmente localizados de solo el 3.2% (es decir 20% del 16%). Estamos hablando de incrementar mediante LSC la supervivencia a 5 años de todo el grupo del 86 a 89%. Haciendo un cálculo del tamaño muestral mediante comparación de proporciones independientes en un contraste bilateral (software Ene 2.0 Glaxo-Smith-Kline, Madrid 2006) para hallar esa diferencia con una potencia del 80% y aleatorización 40/60 (como la del estudio MSLT-I), la muestra necesaria sería de casi 4000 pacientes, 1575 en el grupo de referencia y 2364 en el de intervención. Para detectar esa diferencia tan pequeña la potencia del estudio de Morton con sus 2000 pacientes es de apenas el 40%, manifiestamente insuficiente.
Además en el MSLT1 hubo una violación de protocolo54 que pudo aún disminuir más su capacidad de discernir las potenciales ventajas del grupo de BSGC. Los autores australianos de la Sidney Melanoma Unit que reclutaron casi la mitad de los pacientes del MSLT1 (946 de 2001 pacientes reclutados) reconocieron en 2006 58 que los pacientes del grupo observación fueron examinados mediante linfoescintigrafía. Ésta permitió localizar el GC, que no fue extirpado, pero si tatuada la piel suprayacente permitiendo un seguimiento estrecho clínico-ecográfico de ese GC. Lo positivo fue que constataron que efectivamente las recurrencias se producían en el GC detectado previamente por linfoescintigrafía. Sin embargo se perjudicó gravemente el objetivo principal del estudio al disminuir la ventaja de supervivencia del grupo de BSGC ya que se adelantó en contra de protocolo el diagnóstico y tratamiento de las recurrencias ganglionares del grupo observación.
Para poder dilucidar el dilema habría poner en marcha un macroestudio con el diseño del MSLT-I con suficiente potencia (N>4000) y sin violaciones de protocolo. Un metanálisis publicado en 2010 11 analiza la supervivencia en seis estudios que cumplen criterios y hay menor mortalidad en los pacientes sometidos a LSC (N=1145) frente a las LT (N=1488), con hazard ratio de 1.60 (95% CI 1.28-2.00; P < .0001). Sin embargo ninguno de los estudios analizados es aleatorizado y compara de nuevo lo no comparable, con un evidente sesgo de clasificación y posibilidad de falsos positivos repitiendo el mismo error metodológico de Morton et al 4, que ya anticipaba Piepkorn en 1997 48 y que parece una auténtica plaga metodológica.
A pesar de que el MSLT1 no demostró mejoras en la supervivencia el nuevo ensayo puesto en marcha realiza BSGC a todos los pacientes y aleatoriza en el grupo con BSGC positiva a LSC inmediata frente a una LD diferida solo en el caso de recurrencia clínico-radiológica. Este segundo estudio denominado MLST-II se inició 2004 59, pero habrá que esperar a 2022 a tener resultados completos. Hay autores que anticipan que si va haber diferencias entre ambos grupos, serán mínimas 25, 50.
Riesgo beneficio de la BSGC en morbilidad y económico
Se ha evidenciado pues que si la BSGC/LSC confiere una ventaja de supervivencia respecto a observación/LT esta ventaja es pequeña afectando apenas al 3% del global de pacientes con MM sin enfermedad ganglionar síncrona detectable clínicamente. Si tenemos en cuenta el fenómeno de los falsos positivos la ventaja puede ser de menos del 1% del global, pero si tenemos en cuenta el sesgo introducido por la violación de protocolo mencionada 54, 58 la ventaja podría ser mayor (3-5% del global). Los EC en oncología son tradicionalmente diferentes al resto de especialidades. Se justifican tratamientos realmente muy agresivos a veces en busca de ventajas de supervivencia escasas y en ocasiones a expensas de efectos secundarios importantes con disminución marcada de la calidad de vida. No es el caso de la BSGC pues se ha mostrado como una técnica muy segura con escasas complicaciones, su morbilidad es mínima, muy alejada de la provocada por una linfadenectomía completa 3, 60, 61 y aún más de una LT 62. Esto es un claro argumento a su favor.
Aún así mejorando la supervivencia en un 1-5% del total de pacientes con MM estadío clínico I-II ¿Cuántos pacientes hay que tratar para obtener beneficio? ¿Cuál es el coste de hacer el procedimiento a todos los MM en ese estadio? Hay que hablar de coste económico y de morbilidad. En el económico hay datos muy variables según los países. Los costes añadidos por BSGC en UK año 2000 eran de 1420 libras 22, mientras que en USA en un estudio el coste de BSGC de media fue 15000 dólares, frente a los 1500 que supone el tratamiento ambulatorio que solo contemple escisión amplia del primario. En España 63 el coste es de 1150 euros incluyendo ingreso para BSGC y escisión amplia del primario, frente a los 446 euros de la cirugía ambulatoria (en MM<1mm). En el estudio americano 64 al ser sobre MM delgados, solo 2 de 138 BSGC resultaron positivas, con lo que el coste por paciente con BSGC positiva oscilaba entre 700.000 y un millón de dólares 22.
La morbilidad de la BSGC aunque escasa no es nula y cuando se realiza a toda la cohorte los riesgos se multiplican. Siguiendo a Callender y cols 12 en la época en que “menos es más” en cirugía, cuando se priman los procedimientos ambulatorios y mínimamente invasivos, considerar el estándar de manejo en MM la BSGC y LSC precoz cuando la BSGC es positiva puede ser un error. Esto es así porque considerando riesgos, costes, calidad de vida y resultados actualmente se suele observar donde antes se intervenía 12.
¿Se precisa LSC inmediata tras una BSGC positiva?
De hecho en la actualidad a pesar de las recomendaciones de las guías en USA un estudio estima que solo el 50% de los pacientes con BSGC positiva se someten a LSC precoz 65, 66. Las causas de este fenómeno son la negativa del paciente y la falta de confianza del cirujano en la necesidad del procedimiento 67. La LSC precoz tras BSGC positiva desde luego consigue un muy buen control de la enfermedad ganglionar, pues las recurrencias ganglionares posteriores no llegan al 5% 4. Aún así hay autores que sugieren esperar a que la enfermedad sea aparente clínica o radiológicamente 12 pues en el 84% de las LSC realizadas tras BSGC positiva no encontraremos ya enfermedad ganglionar residual siendo el centinela es el único ganglio afecto como demuestra el propio MSLT-I 4. En ese 84% de LSC estamos generando una morbilidad innecesaria y ya no tan “leve” como la derivada de la BSGC 68. Además los pacientes que demoran la LD pueden tener pronóstico similar a aquellos con LSC precoz 66, 69, aunque este hecho lo responderá con mayor evidencia el MSLT-II. En carcinoma de mama está ocurriendo algo similar 70, la linfadenectomía completa tras un BSGC positiva parece no mejorar la supervivencia en enfermedad microscópica, aunque en este caso la BSGC tiene más valor pues si existen tratamientos adyuvantes (hormonoterapia, quimioterapia,…) que mejoran el pronóstico en pacientes con BSGC positiva. En el caso del MM no disponemos en la actualidad 16, 25 de un tratamiento adyuvante eficaz a la cirugía para enfermedad ganglionar, y el Sunbelt Melanoma Trial 71-73 ha fallado en mostrar beneficio de tratamiento con Interferon en pacientes con BSGC positiva.
La BSGC una buena herramienta para estadiaje y pronóstico.
Aún sin demostrar valor terapéutico la BSGC es idónea para clasificar a los pacientes de riesgo pues nadie discute su valor pronóstico y escasa morbilidad 67. Numerosos estudios demuestran que el estatus de BSGC es un factor pronóstico independiente para supervivencia en MM 23. Si bien la mayoría de los estudios son en MM de espesor intermedio (1-4mm) cuando la BSGC es negativa la supervivencia global a 5 años oscila entre 83–94% comparada con un 56–75% cuando es positiva 34. Disponiendo de la tecnología y presupuesto para su realización dada la escasa morbilidad de la BSGC el debate puede reducirse a una cuestión de medios y/o preferencias del paciente. El optar por BSGC o seguimiento clínico-ecográfico u otros marcadores no invasivos no pasa de ser una opción ya que el beneficio en supervivencia es escaso, hasta ahora indemostrable. Un modelo matemático disponible en la web puede ser muy útil para emular en cada caso concreto como se modifica el pronóstico si contamos con la información que proporciona la BSGC (http://www.lifemath.net/cancer/) Este modelo indica que el estatus marcado por la BSGC modifica el pronóstico especialmente en melanomas intermedios (1-4mm), y no tanto en los gruesos (>4mm) ni en los delgados (<1mm). Puede cuestionarse para qué adelantar el diagnóstico de la enfermedad ganglionar si no se mejora el pronóstico ni con la linfadenectomía precoz ni con el INF 12, 71 . Cada vez más autores ven la BSGC como una técnica a ofrecer y discutir con el paciente y menos como una indicación estándar 16, 18, 19, 50, 54.
La ampliación de criterios en BSGC
En este debate toma plena actualidad la ampliación en los criterios indicación de la BSGC. Todos los estudios iniciales apuntan a que la máxima rentabilidad es en MM de grosor intermedio (1-4 mm). En MM delgado (<1mm) habría menos de un 5% de positividades 35, y en los gruesos (>4mm) la mortalidad estaría en relación con la presencia de metástasis viscerales 34, 50. Las últimas recomendaciones de la AJCC amplían la indicación a los MM a partir de 0.75mm de Breslow si presenta algún factor de riesgo como ulceración, nivel Clark IV, y presencia de 1 mitosis/mm2 en la histología. Hace tiempo que se conoce que ulceración y Clark IV son predictores de positividad de BSGC. Un estudio en 2005 muestra una incidencia de positividad del 12.5% de la BSGC cuando existen 1 o más mitosis por mm2 en MM >0.75mm 74. Esta tasa es superior al 12% de BSGC positivas 35 para MM de 1-2mm. Además los datos recabados en la AJCC de la nueva clasificación de los T1 también apoyan este punto de vista. Así en un análisis multivariado de supervivencia de 4.861 MM < 1mm los predictores con significación estadística fueron grosor tumoral, tasa mitótica y ulceración. De hecho hay una caída de supervivencia a 10 años en los T1 de 95% al 88% cuando la tasa de mitosis es superior a 1/mm2 26. Sin embargo un reciente análisis bayesiano de la literatura publicada 22 apoya la conducta previa de limitar la BSGC a pacientes con MM intermedio pues en MM delgado o grueso su realización apenas modificaría el pronóstico.
El problema de la regresión suscita aún más debate, primero sobre el propio concepto que puede ser cambiante según el estudio 75, y en segundo lugar sobre su significado que podría ser de buen pronóstico para algunos y malo para otros. No tenemos respuesta aún para la cuestión de si se debe proceder a la BSGC en MM delgados con signos de regresión, pues no existe una base científica sólida que apoye una u otra actitud. Parecería lógico que si se sospecha regresión importante ya sea por criterios clínicos, dermoscópicos, o histológicos se contemple la realización de la técnica de BSGC basándose en la teoría de que el tumor que estamos viendo podría haber sido inicialmente más grueso. Sin embargo en el Sunbelt Melanoma Trial 71 apareció regresión entre el 9 y 13.5% según los grupos, y en ningún caso resultó significativa la asociación entre regresión y positividad de la BSGC (p>0.26).
Otro tema muy debatido es el considerar como BSGC positiva la presencia de depósitos ganglionares de MM con menos de 0.1mm de espesor. Esta actitud defendida por la AJCC 26 es rebatida por otros estudios que no encuentran diferencias pronósticas entre lo que denominan submicrometástasis (depósitos de <0.1mm) frente a BSGC negativas 76. La actitud conservadora de nuevo se defiende desde este lado del Atlántico pues es el grupo de melanoma de la EORTC quien revisa BSGC positivas de tres Centros. Utilizan la clasificación de Rotterdam, que valora la carga tumoral ganglionar en tres grupos: <0.1mm, 0.1-1mm y >1mm del eje mayor de la metástasis de mayor tamaño. Un 10% de 388 BSGC positivas son submicrometástasis, con menos de 0.1mm, y su pronóstico es idéntico a los pacientes con BSGC negativas, por lo que no recomiendan la LSC en esos pacientes. Actualmente están abiertos dos ensayos en esta área, el mencionado MSLT-II que aleatoriza a LSC inmediata vs seguimiento, y su contrapartida europea de la EORTC (MINITUB) que aleatoriza en pacientes con mínima carga tumoral a LSC vs seguimiento ecográfico estrecho 50.
Alternativas y/o complementos a la BSGC
La punción aspiración aguja fina (PAAF) ecoguiada se perfila como alternativa a la BSGC pues nuevos trabajos teniendo en cuenta como criterio morfológico la perfusión periférica predicen la afectación ganglionar de dos tercios de las BSGC 77. Esto supone un incremento de la sensibilidad del 30 a más del 75% respecto a publicaciones previas. Ganglios de apenas 0.4mm fueron confirmadas histológicamente 50. Seguimos sin contar con marcadores biológicos que nos indiquen qué MM va a hacer metástasis y hacia dónde. Sin embargo hay datos que apuntan a que el estudio de la linfangiogénesis e invasión linfática en el primario puede ser un buen predictor del desarrrollo de metástasis linfáticas78. En 2005 un análisis multivariable presentaba la extensión de la linfangiogénesis en el primario como el mejor predictor de positividad de GC incluso por delante del breslow79. Un estudio muy reciente con el anticuerpo D2-40 marcador de endotelio linfático permite incrementar la identificación de áreas de invasión linfática del 3 al 21% en MM intermedios80. Y lo que es más importante la presencia de invasión linfática correlacionó con la positividad de la BSGC con valor predictivo positivo del 85% y una especificidad mayor del 95%. Más estudios en esta área podrían seleccionar los pacientes donde la BSGC sería más rentable.
Tampoco están suficientemente desarrolladas las prometedoras vías farmacológicas que a nivel molecular bloqueen ese potencial metastático, aunque hay resultados preliminares alentadores con algunos nuevos fármacos como son los inhibidores de C-KIT como imatinib81, anti-CTLA-4 como ipilimumab 82 o de B-RAF como vemurafenib 83. Lo que consigue curaciones sigue siendo el tratamiento quirúrgico del tumor primario en estadios precoces mediante el cribado clínico y dermoscópico de los pacientes de riesgo 84 así como el tratamiento de la enfermedad ganglionar precozmente mediante BSGC o a la menor manifiestación clínica o radiológica 66. Esta aproximación está llevando la supervivencia del MM en USA a tasas por encima del 90% a 10 años (http://seer.cancer.gov/faststats/selections.php?series=cancer)
¿Qué manejo podemos recomendar a nuestros pacientes?
La evidencia acumulada tras años de estudio de la enfermedad ganglionar por melanoma nos permite clasificar pacientes con enfermedad ganglionar con pronóstico muy diferente. El peor escenario corresponde a la presencia de metástasis ganglionares macroscópicas (detectadas clínica o radiológicamente) síncronas, es decir en el momento del diagnóstico del primario36. Todo el mundo está de acuerdo que a estos pacientes hay que realizarles LT completa, y su mortalidad vendrá definida por el número de ganglios afectos. La detección clínico-radiológica de metástasis ganglionares asíncronas exige igualmente LT con iguales consideraciones pero menor mortalidad.

Figura 3.- Algoritmo de manejo del MM estadio I-II sugerido por los autores y basado en las recomendaciones de la guía de la NCCN 2011; FR: factores de riesgo incluyendo ulceración, 1 mitosis/mm2 o Clark IV. Invasión linfática medida en el primario mediante D2-40. BSGC: Biopsia Selectiva de Ganglio Centinela.
En el resto de escenarios no hay certezas y se abren opciones diversas admitidas por las diferentes guías. Si no hay enfermedad ganglionar detectable ni clínica ni radiológicamente, la mejoría de supervivencia detectando precozmente una enfermedad microscópica mediante BSGC y realizando LSC en caso de positividad de la misma sería solo teórica, no demostrada, y afectando a un escaso 2-3% del total de pacientes estadios I-II. Es cierto que el 80% de la enfermedad ganglionar es diagnosticada y tratada precozmente mediante BSGC con baja morbilidad. Es una buena opción pero, al no demostrar beneficio en supervivencia, en las últimas versiones de las guías de la NCCN y EORTC se propone no indicar sino ofertar y discutir con el paciente la realización BSGC. En la mencionada guía de la NCCN 2011 la presencia de co-morbilidades importantes o la preferencia del paciente pueden hacer factible la opción del seguimiento cercano clínico-ecográfico frente a la indicación de BSGC (Figura 3). Además un 3-5% del total de pacientes (20% de la enfermedad ganglionar potencial), son falsos negativos para la BSGC y originarán recurrencias tardías. Una BSGC negativa no elimina la posibilidad de recurrencia ganglionar, por tanto el seguimiento clínico-ecográfico es en cualquier caso ineludible. Una buena opción para optimizar la indicación de BSGC puede ser el estudio de la linfangiogénesis y la invasión linfática en el tumor primario mediante el anticuerpo D2-40 79, 80 que abre nuevas líneas de investigación.
Por otro lado es evidente que la linfoescintigrafía localiza con precisión el ganglio que con mayor probabilidad puede afectarse o estar afecto de inicio3. Una opción intermedia entre BSGC y observación, sería identificar este ganglio mediante linfoescintigrafía, como se hizo en el grupo australiano del MSLT-1 58 con marcaje de la piel suprayacente con un tatuaje. Esto permitiría al propio paciente y al dermatólogo hacer seguimiento clínico y/o ecográfico de ese ganglio concreto. En caso de ecografía positiva (con o sin punción aspiración positiva con aguja fina) 77 de un único ganglio se haría BSGC del mismo. Si hubiera varios ganglios afectos se recomendaría LDC.
El detectar una afectación microscópica del GC tiene significado pronóstico pero no beneficio demostrado, más aun la supervivencia puede ser similar tanto si realizamos LSC precoz tras BSGC positiva, que demorando la LSC a la espera de detección de enfermedad clínico-radiológica en el resto de la cadena 66. La morbilidad global que se evita puede ser importante ya que más del 80% de pacientes no tendrán enfermedad adicional ganglionar 4. La NCCN en 2011 da como opción el seguimiento clinico-ecográfico estrecho ante una BSGC positiva aunque recomienda hacerlo dentro de un ensayo clínico. Habrá que esperar a que los dos ensayos en marcha ya mencionados (MSLT-II y MINITUB) aporten mayor evidencia en este debate.
De igual forma en caso de BSGC positiva el paciente debe ser informado que si el depósito es submicroscópico (<0.1mm), la opción más adecuada puede ser vigilancia estrecha, y si es >0.2mm podremos optar por vigilancia estrecha o LSC precoz85. Muchos pacientes y médicos en USA obvian las recomendaciones de la AJCC pues deciden no hacer LSC a pesar de tener BSGC positivas 67. ¿Debemos hacer un manejo diferente menos intervencionista de la enfermedad ganglionar en Europa frente a USA como ya ocurrió en el pasado? 45 A la espera de los resultados del MSLT-2 puede ser lo más prudente 50, especialmente cuando existe afectación submicroscópica. Otros factores de la anatomía del ganglio diferentes de la carga tumoral debieran ser explorados.
La comunidad científica y los pacientes con MM tienen mucho que agradecer al gran esfuerzo investigador realizado por grupos como el John Wayne Institute, la AJCC o la Sociedad Internacional del Ganglio Centinela. No obstante pudiera ser el momento de recapacitar sobre la progresiva ampliación de las indicaciones de la BSGC y las actitudes más intervencionistas. Por el contrario una reciente revisión sobre ganglio centinela en MM de Gershenwald et al 23 publicada en New England Journal of Medicine este mayo no hace alusión a ninguno de los mencionados artículos 12-21, 51, 54 que cuestionan el procedimiento y alertan de los sesgos del MSLT-I.
Es evidente que la BSGC es un buen procedimiento con pros y contras y que debe considerarse como tal. En cualquier caso los escenarios en medicina son cambiantes, y la aparición de nuevos tratamientos pueden hacer de la BSGC una indicación estándar ineludible en un futuro. Esto ya ocurre en cáncer de mama donde hay tratamiento adyuvante eficaz en caso de BSGC positiva, no así desgraciadamente en MM donde al menos si existe una pujante y prometedora línea de investigación en terapia dirigida por la presencia o no de alteraciones moleculares. Aún siendo una buena opción, en la actualidad la BSGC no debe considerarse de forma inflexible el estándar único de manejo cuando no se aprecia afectación ganglionar clínico-ecográfica, y puede optarse por seguimiento clínico-ecográfico siempre matizado por la opinión del paciente y dermatólogo individualizando cada caso.
CONCLUSIONES:
Tras 20 años de andadura, aún siendo una buena opción, la BSGC no puede considerarse un estándar práctico de manejo indiscutible en el estadiaje del MM puesto que no se ha demostrado que modifique la supervivencia per se ni anticipando tratamientos quirúrgicos o adyuvantes54. Es cierto que en manos entrenadas tiene una morbilidad muy baja y es muy buen predictor de supervivencia enfermedad específica especialmente en MM de grosor intermedio3. Está por definir el significado biológico del concepto de micrometástasis que no parece deba ser ampliado al de submicrometástasis como depósitos sin límite inferior76. Se discute la necesidad de linfadenectomía completa tras positividad de la BSGC, y se precisan criterios histológicos firmes, especialmente la carga tumoral ganglionar, para definir la conducta a seguir. La BSGC debe considerarse más como una técnica a ofrecer y discutir con los pacientes que una indicación estándar. Una alternativa podría ser localización con linfoescintigrafía marcando con tatuaje el GC para estudio y seguimiento ecográfico del mismo. En el estadiaje y seguimiento del MM estadíos I-II deben ser exploradas otras vías pronósticas alternativas o complementarias como el análisis histológico del tumor primario, incluyendo linfangiogénesis, y técnicas de imagen 50.
BIBLIOGRAFÍA:
(1) Holmes EC, Moseley HS, Morton DL, Clark W, Robinson D, Urist MM. A rational approach to the surgical management of melanoma. Ann Surg 1977 Oct;186(4):481-90.
(2) Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992 Apr;127(4):392-9.
(3) Ross MI. Sentinel node biopsy for melanoma: an update after two decades of experience. Semin Cutan Med Surg 2010 Dec;29(4):238-48.
(4) Morton DL, Thompson JF, Cochran AJ, Mozzillo N, Elashoff R, Essner R, et al. Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 2006 Sep 28;355(13):1307-17.
(5) Morton DL, Cochran AJ, Thompson JF. Authors’ response to a letter to the editor re: Sentinel node biopsy for early-stage melanoma. Ann Surg 2007 May;245(5):828-9.
(6) Cochran AJ, Thompson JF. Lymphatic mapping and sentinel node biopsy: the data unclouded by speculation. Arch Dermatol 2008 May;144(5):687-8.
(7) Morton DL, Cochran AJ, Thompson JF. The rationale for sentinel-node biopsy in primary melanoma. Nat Clin Pract Oncol 2008 Sep;5(9):510-1.
(8) Morton DL, Elashoff R. Sentinel node biopsy: facts to clear the alleged clouds. Arch Dermatol 2008 May;144(5):685-6.
(9) Ross MI, Gershenwald JE. How should we view the results of the Multicenter Selective Lymphadenectomy Trial-1 (MSLT-1)? Ann Surg Oncol 2008 Mar;15(3):670-3.
(10) Balch CM, Morton DL, Gershenwald JE, McMasters KM, Nieweg OE, Powell B, et al. Sentinel node biopsy and standard of care for melanoma. J Am Acad Dermatol 2009 May;60(5):872-5.
(11) Pasquali S, Mocellin S, Campana LG, Bonandini E, Montesco MC, Tregnaghi A, et al. Early (sentinel lymph node biopsy-guided) versus delayed lymphadenectomy in melanoma patients with lymph node metastases : personal experience and literature meta-analysis. Cancer 2010 Mar 1;116(5):1201-9.
(12) Callender GG, McMasters KM. Early versus delayed complete lymphadenectomy in melanoma: insight from MSLT I. Ann Surg Oncol 2011 Feb;18(2):306-8.
(13) Gonzalez U. Cloud over sentinel node biopsy: unlikely survival benefit in melanoma. Arch Dermatol 2007 Jun;143(6):775-6.
(14) Grichnik JM. Sentinel-node biopsy in melanoma. N Engl J Med 2007 Jan 25;356(4):418-9.
(15) Kanzler MH, Levitt L, Lin A. Sentinel-node biopsy in melanoma. N Engl J Med 2007 Jan 25;356(4):419-21.
(16) Kanzler MH. Sentinel node biopsy and standard of care for melanoma: a re-evaluation of the evidence. J Am Acad Dermatol 2010 May;62(5):880-4.
(17) Retsas S. Sentinel-node biopsy in melanoma. N Engl J Med 2007 Jan 25;356(4):419-21.
(18) Rogers HW, Coldiron BM. Sentinel node biopsy not standard of care for melanoma. J Am Acad Dermatol 2011 Feb;64(2):441.
(19) Sladden MJ, Foley P, Stanford DG, Zagarella S, Reid C. Sentinel node biopsy: not the standard of care for melanoma. J Am Acad Dermatol 2010 Apr;62(4):708-9.
(20) Thomas JM. Caution with sentinel node biopsy in cutaneous melanoma. Br J Surg 2006 Feb;93(2):129-30.
(21) Thomas JM. Sentinel-node biopsy in melanoma. N Engl J Med 2007 Jan 25;356(4):418-21.
(22) Rhodes AR. Prognostic usefulness of sentinel lymph node biopsy for patients who have clinically node negative, localized, primary invasive cutaneous melanoma: a bayesian analysis using informative published reports. Arch Dermatol 2011 Apr;147(4):408-15.
(23) Gershenwald JE, Ross MI. Sentinel-lymph-node biopsy for cutaneous melanoma. N Engl J Med 2011 May 5;364(18):1738-45.
(24) Mangas C, Paradelo C, Rex J, Ferrandiz C. [The role of sentinel lymph node biopsy in the diagnosis and prognosis of malignant melanoma]. Actas Dermosifiliogr 2008 Jun;99(5):331-48.
(25) Pizarro A. [Why does sentinel lymph node biopsy not increase survival in patients with melanoma?]. Actas Dermosifiliogr 2008 Jun;99(5):323-30.
(26) Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009 Dec 20;27(36):6199-206.
(27) Cancer Council Australia andAustralian Cancer Network SaNZGGW2. Clinical Practice Guidelines for the Management of Melanoma in Australia and New Zealand. . Cancer Council Australia andAustralian Cancer Network, Sydney and New Zealand Guidelines Group, Wellington (2008) 2008
(28) Chakera AH, Hesse B, Burak Z, Ballinger JR, Britten A, Caraco C, et al. EANM-EORTC general recommendations for sentinel node diagnostics in melanoma. Eur J Nucl Med Mol Imaging 2009 Oct;36(10):1713-42.
(29) Gershenwald JE, Tseng CH, Thompson W, Mansfield PF, Lee JE, Bouvet M, et al. Improved sentinel lymph node localization in patients with primary melanoma with the use of radiolabeled colloid. Surgery 1998 Aug;124(2):203-10.
(30) Kelemen PR, Wanek LA, Morton DL. Lymph node biopsy does not impair survival after therapeutic dissection for palpable melanoma metastases. Ann Surg Oncol 1999 Mar;6(2):139-43.
(31) Morton DL, Wanek L, Nizze JA, Elashoff RM, Wong JH. Improved long-term survival after lymphadenectomy of melanoma metastatic to regional nodes. Analysis of prognostic factors in 1134 patients from the John Wayne Cancer Clinic. Ann Surg 1991 Oct;214(4):491-9.
(32) Ross MI. Surgical management of stage I and II melanoma patients: approach to the regional lymph node basin. Semin Surg Oncol 1996 Nov;12(6):394-401.
(33) Gershenwald JE, Colome MI, Lee JE, Mansfield PF, Tseng C, Lee JJ, et al. Patterns of recurrence following a negative sentinel lymph node biopsy in 243 patients with stage I or II melanoma. J Clin Oncol 1998 Jun;16(6):2253-60.
(34) van Akkooi AC, Verhoef C, Eggermont AM. Importance of tumor load in the sentinel node in melanoma: clinical dilemmas. Nat Rev Clin Oncol 2010 Aug;7(8):446-54.
(35) Rousseau DL, Jr., Ross MI, Johnson MM, Prieto VG, Lee JE, Mansfield PF, et al. Revised American Joint Committee on Cancer staging criteria accurately predict sentinel lymph node positivity in clinically node-negative melanoma patients. Ann Surg Oncol 2003 Jun;10(5):569-74.
(36) Pilko G, Besic N, Zgajnar J, Hocevar M. Prognostic heterogeneity after the excision of lymph node metastases in patients with cutaneous melanoma. Surg Oncol 2011 Mar;20(1):26-34.
(37) Balch CM, Buzaid AC, Soong SJ, Atkins MB, Cascinelli N, Coit DG, et al. Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma. J Clin Oncol 2001 Aug 15;19(16):3635-48.
(38) Karakousis CP, Seddiq MK, Moore R. Prognostic value of lymph node dissection in malignant melanoma. Arch Surg 1980 Jun;115(6):719-22.
(39) Soong SJ, Harrison RA, McCarthy WH, Urist MM, Balch CM. Factors affecting survival following local, regional, or distant recurrence from localized melanoma. J Surg Oncol 1998 Apr;67(4):228-33.
(40) Meier F, Will S, Ellwanger U, Schlagenhauff B, Schittek B, Rassner G, et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. Br J Dermatol 2002 Jul;147(1):62-70.
(41) Medalie N, Ackerman AB. Sentinel node biopsy has no benefit for patients whose primary cutaneous melanoma has metastasized to a lymph node and therefore should be abandoned now. Br J Dermatol 2004 Aug;151(2):298-307.
(42) Balch CM, Soong S, Ross MI, Urist MM, Karakousis CP, Temple WJ, et al. Long-term results of a multi-institutional randomized trial comparing prognostic factors and surgical results for intermediate thickness melanomas (1.0 to 4.0 mm). Intergroup Melanoma Surgical Trial. Ann Surg Oncol 2000 Mar;7(2):87-97.
(43) Cascinelli N, Morabito A, Santinami M, Mackie RM, Belli F. Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 1998 Mar 14;351(9105):793-6.
(44) Hein DW, Moy RL. Elective lymph node dissection in stage I malignant melanoma: a meta-analysis. Melanoma Res 1992 Nov;2(4):273-7.
(45) McCarthy WH, Shaw HM, Cascinelli N, Santinami M, Belli F. Elective lymph node dissection for melanoma: two perspectives. World J Surg 1992 Mar;16(2):203-13.
(46) Sim FH, Taylor WF, Pritchard DJ, Soule EH. Lymphadenectomy in the management of stage I malignant melanoma: a prospective randomized study. Mayo Clin Proc 1986 Sep;61(9):697-705.
(47) Coates AS, Ingvar CI, Petersen-Schaefer K, Shaw HM, Milton GW, O’Brien CJ, et al. Elective lymph node dissection in patients with primary melanoma of the trunk and limbs treated at the Sydney Melanoma unit from 1960 to 1991. J Am Coll Surg 1995 Apr;180(4):402-9.
(48) Piepkorn M, Weinstock MA, Barnhill RL. Theoretical and empirical arguments in relation to elective lymph node dissection for melanoma. Arch Dermatol 1997 Aug;133(8):995-1002.
(49) Gutzmer R, Al GM, Geerlings H, Kapp A. Sentinel node biopsy in melanoma delays recurrence but does not change melanoma-related survival: a retrospective analysis of 673 patients. Br J Dermatol 2005 Dec;153(6):1137-41.
(50) van Akkooi AC, Voit CA, Verhoef C, Eggermont AM. New developments in sentinel node staging in melanoma: controversies and alternatives. Curr Opin Oncol 2010 May;22(3):169-77.
(51) Thomas JM. Prognostic false-positivity of the sentinel node in melanoma. Nat Clin Pract Oncol 2008 Jan;5(1):18-23.
(52) van Akkooi AC, de Wilt JH, Voit C, Verhoef C, Suciu S, Eggermont AM. Sentinel lymph-node false positivity in melanoma. Nat Clin Pract Oncol 2008 Apr;5(4):E2.
(53) Morton DL. Morton DL and the MSLT-2 Trials Group. Interim update of MSLT-Iand MSLT-II. 2008 Feb 18; 2008.
(54) Thomas JM. Concerns relating to the conduct and statistical analysis of the Multicenter Selective Lymphadenectomy Trial (MSLT-1) in patients with melanoma. J Plast Reconstr Aesthet Surg 2009 Apr;62(4):442-6.
(55) Murugkar P, Azawi K, Humzah D. The sleeper cells: delayed sentinel lymph node biopsy. J Plast Reconstr Aesthet Surg 2007;60(12):1357-60.
(56) Yusuf S, Wittes J, Probstfield J, Tyroler HA. Analysis and interpretation of treatment effects in subgroups of patients in randomized clinical trials. JAMA 1991 Jul 3;266(1):93-8.
(57) Daly LE, Bourke GJ. Interpretation and uses of medical statistics. 5th ed. ed. 2000.
(58) Thompson JF, Shaw HM. Benefits of sentinel node biopsy for melanoma: a review based on interim results of the first Multicenter Selective Lymphadenectomy Trial. ANZ J Surg 2006 Mar;76(3):100-3.
(59) Morton DL. Multicenter Selective Lymphadenectomy Trial II (MSLT-II). US National Institute of Health 2011 March 22 [cited 2011 May 25];Available from: URL: http://clinicaltrials.gov/show/NCT00297895
(60) Kretschmer L, Thoms KM, Peeters S, Haenssle H, Bertsch HP, Emmert S. Postoperative morbidity of lymph node excision for cutaneous melanoma-sentinel lymphonodectomy versus complete regional lymph node dissection. Melanoma Res 2008 Feb;18(1):16-21.
(61) Guggenheim MM, Hug U, Jung FJ, Rousson V, Aust MC, Calcagni M, et al. Morbidity and recurrence after completion lymph node dissection following sentinel lymph node biopsy in cutaneous malignant melanoma. Ann Surg 2008 Apr;247(4):687-93.
(62) Faries MB, Thompson JF, Cochran A, Elashoff R, Glass EC, Mozzillo N, et al. The impact on morbidity and length of stay of early versus delayed complete lymphadenectomy in melanoma: results of the Multicenter Selective Lymphadenectomy Trial (I). Ann Surg Oncol 2010 Dec;17(12):3324-9.
(63) Almazan-Fernandez FM, Serrano-Ortega S, Moreno-Villalonga JJ. [Descriptive study of the costs of diagnosis and treatment of cutaneous melanoma]. Actas Dermosifiliogr 2009 Nov;100(9):785-91.
(64) Agnese DM, Abdessalam SF, Burak WE, Jr., Magro CM, Pozderac RV, Walker MJ. Cost-effectiveness of sentinel lymph node biopsy in thin melanomas. Surgery 2003 Oct;134(4):542-7.
(65) Bilimoria KY, Balch CM, Bentrem DJ, Talamonti MS, Ko CY, Lange JR, et al. Complete lymph node dissection for sentinel node-positive melanoma: assessment of practice patterns in the United States. Ann Surg Oncol 2008 Jun;15(6):1566-76.
(66) Kingham TP, Panageas KS, Ariyan CE, Busam KJ, Brady MS, Coit DG. Outcome of patients with a positive sentinel lymph node who do not undergo completion lymphadenectomy. Ann Surg Oncol 2010 Feb;17(2):514-20.
(67) McMasters KM. Why does no one want to perform lymph node dissection anymore? Ann Surg Oncol 2010 Feb;17(2):358-61.
(68) McMasters KM, Noyes RD, Reintgen DS, Goydos JS, Beitsch PD, Davidson BS, et al. Lessons learned from the Sunbelt Melanoma Trial. J Surg Oncol 2004 Jul 1;86(4):212-23.
(69) Wong SL, Morton DL, Thompson JF, Gershenwald JE, Leong SP, Reintgen DS, et al. Melanoma patients with positive sentinel nodes who did not undergo completion lymphadenectomy: a multi-institutional study. Ann Surg Oncol 2006 Jun;13(6):809-16.
(70) Viehl CT, Langer I, Guller U, Zanetti-Dallenbach R, Moch H, Wight E, et al. Prognostic impact and therapeutic implications of sentinel lymph node micro-metastases in early-stage breast cancer patients. J Surg Oncol 2011 May 1;103(6):531-3.
(71) McMasters KM, Edwards MJ, Ross MI, Reintgen DS, Martin RC, Urist MM, et al. Ulceration as a predictive marker for response to adjuvant interferon therapy in melanoma. Ann Surg 2010 Sep;252(3):460-5.
(72) Stebbins WG, Garibyan L, Sober AJ. Sentinel lymph node biopsy and melanoma: 2010 update Part II. J Am Acad Dermatol 2010 May;62(5):737-48.
(73) McMasters KM, Ross MI, Reintgen DS. Final results of the Sunbelt Melanoma Trial . J Clin Oncol 2008 [cited 2011 May 25];26(suppl).Available from: URL: http://meeting.ascopubs.org/cgi/content/abstract/26/15_suppl/9003.
(74) Kesmodel SB, Karakousis GC, Botbyl JD, Canter RJ, Lewis RT, Wahl PM, et al. Mitotic rate as a predictor of sentinel lymph node positivity in patients with thin melanomas. Ann Surg Oncol 2005 Jun;12(6):449-58.
(75) Requena C, Botella-Estrada R, Traves V, Nagore E, Almenar S, Guillen C. [Problems in defining melanoma regression and prognostic implication]. Actas Dermosifiliogr 2009 Nov;100(9):759-66.
(76) van Akkooi AC, Nowecki ZI, Voit C, Schafer-Hesterberg G, Michej W, de Wilt JH, et al. Sentinel node tumor burden according to the Rotterdam criteria is the most important prognostic factor for survival in melanoma patients: a multicenter study in 388 patients with positive sentinel nodes. Ann Surg 2008 Dec;248(6):949-55.
(77) Voit CA, van Akkooi AC, Schafer-Hesterberg G, Schoengen A, Schmitz PI, Sterry W, et al. Rotterdam Criteria for sentinel node (SN) tumor burden and the accuracy of ultrasound (US)-guided fine-needle aspiration cytology (FNAC): can US-guided FNAC replace SN staging in patients with melanoma? J Clin Oncol 2009 Oct 20;27(30):4994-5000.
(78) Tejera-Vaquerizo A, Solis-Garcia E, Rios-Martin JJ, Moreno-Ramirez D. [Primary cutaneous melanoma: prognostic factors not included in the classification of the American Joint Committee on Cancer]. Actas Dermosifiliogr 2011 May;102(4):255-63.
(79) Dadras SS, Lange-Asschenfeldt B, Velasco P, Nguyen L, Vora A, Muzikansky A, et al. Tumor lymphangiogenesis predicts melanoma metastasis to sentinel lymph nodes. Mod Pathol 2005 Sep;18(9):1232-42.
(80) Fohn LE, Rodriguez A, Kelley MC, Ye F, Shyr Y, Stricklin G, et al. D2-40 lymphatic marker for detecting lymphatic invasion in thin to intermediate thickness melanomas: association with sentinel lymph node status and prognostic value-a retrospective case study. J Am Acad Dermatol 2011 Feb;64(2):336-45.
(81) Carvajal RD, Antonescu CR, Wolchok JD, Chapman PB, Roman RA, Teitcher J, et al. KIT as a therapeutic target in metastatic melanoma. JAMA 2011 Jun 8;305(22):2327-34.
(82) Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010 Aug 19;363(8):711-23.
(83) Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, et al. Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation. N Engl J Med 2011 Jun 5.
(84) Mangas C, Paradelo C, Puig S, Gallardo F, Marcoval J, Azon A, et al. [Initial evaluation, diagnosis, staging, treatment, and follow-up of patients with primary cutaneous malignant melanoma. Consensus statement of the Network of Catalan and Balearic Melanoma Centers]. Actas Dermosifiliogr 2010 Mar;101(2):129-42.
(85) van Akkooi AC, de Wilt JH, Verhoef C, Schmitz PI, van Geel AN, Eggermont AM, et al. Clinical relevance of melanoma micrometastases (<0.1 mm) in sentinel nodes: are these nodes to be considered negative? Ann Oncol 2006 Oct;17(10):1578-85.















Palabras Clave: carga tumoral, ganglio centinela, manejo estándar, melanoma, pronóstico