Bases moleculares implicadas en la terapia combinada antihormonal y antiangiogénica en el cáncer de mama
Berciano Guerrero, Miguel Angel
DIRECTORES DE TESIS:
Prof. Dr. Enrique Aranda Aguilar.
Dr. Juan de la Haba Rodríguez.
INTRODUCCIÓN:
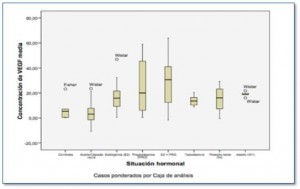
Los datos procedentes de laboratorio nos han acercado a los mecanismos implicados en la respuesta al tratamiento antihormonal o a aquellos que intervienen en la respuesta a una terapia antiangiogénica. Es muy conocida la asociación entre los conceptos de angiogénesis y estado hormonal, tanto en condiciones fisiológicas como en patológicas [1,2]. Con esa premisa, nuestro grupo realizó un estudio sobre un modelo murino, en colaboración con el Departamento de Fisiología Humana de la Facultad de Medicina de la Universidad de Córdoba y con el Servicio de Oncología Médica del Hospital Virgen de la Victoria de Málaga. Como se aprecia en la Figura 1, se expusieron diferentes ratas de raza Fisher y Wistar, tanto macho como hembras, a diferente situación hormonal. Tal y como presentamos en el congreso americano de ASCO de 2010 [3], nuestro estudio demostró la alteración en los niveles séricos de VEGF tras la diferente variación del estado hormonal.
En la actualidad, existen ensayos clínicos en marcha que estudiarán el valor de la combinación de las terapias antiangiogénica y antihormonal [4], aunque se apoyan en escasos estudios preclínicos [5]. Dichas investigaciones podrían revelar algunos aspectos moleculares para un uso más racional de dicha combinación terapéutica [6].
OBJETIVOS:
En cuanto a los objetivos, nos planteamos:
1) Conocer la actividad in vitro de bevacizumab, en diferentes líneas celulares de cáncer de mama, determinando su efecto antitumoral, midiendo la proliferación y la inducción a la apoptosis.
2) Observar cómo la dependencia hormonal produce una variabilidad en las condiciones de proliferación celular y la acción de tratamientos anti-diana.
3) Describir la acción autocrina de VEGF en la célula tumoral, comprobando cómo se alteran sus rutas de señalización intracelular y sus receptores.
4) Analizar la secreción de VEGF al medio de cultivo extracelular, en función de los tratamientos y ambiente estrogénico.
MATERIAL Y MÉTODOS:
Utilizamos líneas celulares de cáncer de mama con diferente dependencia estrogénica (MCF-7, BT-474 y MDA-MB-231). Dichas células se sometieron a un gradiente estrogénico (con estradiol) y fueron tratadas con antiestrogénicos (fulvestrant o tamoxifeno) con o sin un antiangiogénico puro (bevacizumab -anti-VEGF [vascular endothelial growth factor]-). Se determinaron la proliferación y la apoptosis celular. Con la técnica de western-blot, utilizando anticuerpos específicos, se analizaron, además, vías de señalización intracelular implicadas en la proliferación y supervivencia de la célula, aparte de la activación de receptores estrogénicos y la activación de la enzima ciclooxigenasa-2. La cuantificación de los niveles de VEGF-A (mayor proangiogénico) se realizó mediante la técnica de ELISA.
RESULTADOS:
Nuestros resultados mostraron que en las líneas celulares con dependencia estrogénica (MCF-7 y BT-474) el efecto pro-proliferativo del estradiol disminuyó después de tratamiento con bevacizumab, no variándose la proliferación de la línea hormonodependiente MDA-MB-231 (como se aprecia en las Figuras 2A, 2B y 2C).
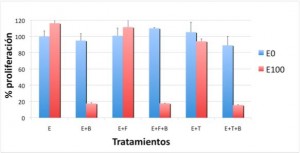 Figura 2A. Proliferación de la línea MCF-7 tras los diferentes tratamientos:
Figura 2A. Proliferación de la línea MCF-7 tras los diferentes tratamientos:
B = bevacizumab
F = fulvestrant
E0 = sin estradiol
E100 = estradiol 100 nM
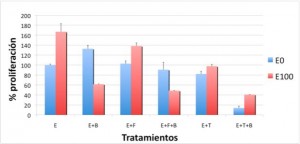 Figura 2B. Proliferación de la línea BT-474 tras los diferentes tratamientos:
Figura 2B. Proliferación de la línea BT-474 tras los diferentes tratamientos:
B = bevacizumab
F = fulvestrant
E0 = sin estradiol
E100 = estradiol 100 nM
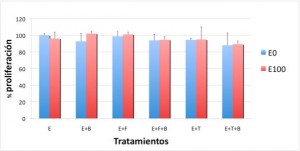 Figura 2C. Proliferación de la línea MDA-MB-231 tras los diferentes tratamientos:
Figura 2C. Proliferación de la línea MDA-MB-231 tras los diferentes tratamientos:
B = bevacizumab
F = fulvestrant
E0 = sin estradiol
E100 = estradiol 100 nM
Además, la combinación de antiangiogénicos y antiestrógenos mejoró el efecto antiproliferativo, constatándose unos niveles menores de VEGF-A en el medio de cultivo y una disminución de la fosforilación de ER α, en dichas líneas hormonodependientes, constatándose la acción autocrina de VEGF-A en distintas células tumorales [7]. A pesar de todo lo anterior, la apoptosis celular no se vio afectada, a diferencia de lo que habría ocurrido en modelos in vivo [8]. El tratamiento combinado también alteró la fosforilación de las quinasas Akt y Erk 1/2, implicadas en la proliferación y supervivencia celular [9]. Las diferentes vías de señalización intracelular pueden apreciarse en la Tabla 1, donde se aprecian cómo la presencia estrogénica favorecía la acción tanto del antiestrógeno como del antiangiogénico, en la línea hormonoindependiente MCF-7.
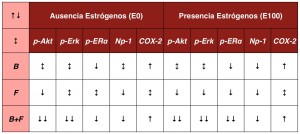 Tabla 1. Señalización intracelular en MCF-7 en función de los tratamientos
Tabla 1. Señalización intracelular en MCF-7 en función de los tratamientos
B = bevacizumab
F = fulvestrant
E0 = sin estradiol
E100 = estradiol 100 nM
De forma interesante, la actividad de COX-2 se modificó por los tratamientos antihormonales y antiangiogénicos de un modo diferente, según la línea celular, no estando en función de los receptores hormonales como algunos artículos habían afirmado [10].
CONCLUSIONES:
De los datos presentados en el trabajo, se concluye que:
- El bloqueo de VEGF-A, mediante el anticuerpo monoclonal bevacizumab, inhibe la proliferación en líneas celulares de cáncer de mama. Esta inhibición ocurre en aquellas líneas celulares que expresan receptores hormonales y en presencia de estrógenos.
- Además, el bloqueo dual de VEGF y del receptor estrogénico alpha, supone una inhibición de las vías de proliferación, así como en las vías de supervivencia celular, a través de Akt y Erk.
-
El bloqueo por bevacizumab induce una inhibición en el estado de fosforilación del receptor estrogénico alpha, que se hace mayor en presencia de estrógenos y en combinación con un antiestrógeno puro (fulvestrant).
-
Las diferentes líneas celulares, en función de su expresión de receptores hormonales y del estado de sobreexpresión de HER-2, producen una diferente activación o inhibición en la expresión de la ciclooxigenasa-2, enzima implicada en el proceso de angiogénesis.
BIBLIOGRAFÍA:
-
1. Hyder, SM (2006). Sex-steroid regulation of vascular endothelial growth factor in breast cancer. Endocr Relat Cancer, 13(3), 667.
-
2. Folkerd, EJ, Dowsett, M (2010). Influence of sex hormones on cancer progression. Journal of Clinical Oncology, 28(26), 4038.
-
3. Berciano-Guerrero, MA, de la Haba Rodríguez, J, Castellano, J, Porras, I, Pulido, G, Jiménez, J, Sempere, MT, Barneto, I, Aranda, E (2010). Effect of sex steroid hormones on serum levels of vascular endothelial growth factor (VEGF) in a murine model. –J Clin Oncol –ASCO Meeting Abstracts. 28 (15): e21097
-
4. Sanchez Rovira P, De la Haba J, Fernández-Navarro M, Seguí M, Llombart-Cussac A, Anton A, Alba E, Aranda E: Predictive response factors (PRF) in an open, nonrandomized, phase II study of a combination of bevacizumab (BZ) and sequential chemotherapy as preoperative treatment in patients with operable HER2-negative breast cancer (BC). J Clin Oncol 28:15s, 2010 (suppl) Abstract #556.
-
5. Banerjee, S, A’hern, R, Detre, S, Littlewood-Evans, AJ, Evans, DB, Dowsett, M, Martin, LA (2010). Biological Evidence for Dual Antiangiogenic-Antiaromatase Activity of the VEGFR Inhibitor PTK787/ZK222584 In vivo. Clinical cancer research : an official journal of the American Association for Cancer Research,
-
6. Normanno, N, Morabito, A, De Luca, A, Piccirillo, MC, Gallo, M, Maiello, MR, Perrone, F (2009). Target-based therapies in breast cancer: current status and future perspectives. Endocr Relat Cancer, 16(3), 675.
-
7. Weigand, M, Hantel, P, Kreienberg, R, Waltenberger, J (2005). Autocrine vascular endothelial growth factor signalling in breast cancer. Evidence from cell lines and primary breast cancer cultures in vitro. Angiogenesis, 8(3), 197.
-
8. Wedam, SB, Low, JA, Yang, SX, Chow, CK, Choyke, P, Danforth, D, Hewitt, SM, Berman, A, Steinberg, SM, Liewehr, DJ, Plehn, J, Doshi, A, Thomasson, D, McCarthy, N, Koeppen, H, Sherman, M, Zujewski, J, Camphausen, K, Chen, H, Swain, SM (2006). Antiangiogenic and antitumor effects of bevacizumab in patients with inflammatory and locally advanced breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 24(5), 769.
-
9. Osborne, CK, Shou, J, Massarweh, S, Schiff, R (2005). Crosstalk between estrogen receptor and growth factor receptor pathways as a cause for endocrine therapy resistance in breast cancer. Clin Cancer Res, 11(2 Pt 2), 865s.
-
10. Sirois, J, Simmons, DL, Richards, JS (1992). Hormonal regulation of messenger ribonucleic acid encoding a novel isoform of prostaglandin endoperoxide H synthase in rat preovulatory follicles. Induction in vivo and in vitro. J Biol Chem, 267(16), 11586.














Palabras Clave: antiangiogénica, antihormonal, cáncer de mama