Práctica basada en la evidencia: Un reto en tiempos de crisis
César Llorente-Parrado. Marta Grande-Arnesto. Hospital General Universitario de Ciudad Real. Unidad de Calidad.
RESUMEN
Objetivos. Definir las principales barreras que pueden limitar la adecuación de la atención sanitaria a la evidencia científica. Describir propuestas de mejora para potenciar la Práctica Basada en la Evidencia en los centros sanitarios.
Estrategia de búsqueda. La búsqueda de artículos se ha realizado a través de tripdatabase, sumsearch, excelencia clínica y google –búsqueda avanzada-. Palabras clave, en castellano e inglés, medicina basada en la evidencia, adecuación de tecnología sanitaria, información sanitaria, evaluación económica. Búsqueda realizada en julio de 2011.
Selección de artículos. Los artículos se seleccionan en función tanto de su relación específica con los objetivos como de su actualidad.
Síntesis de resultados. Las dificultades tanto en la identificación de la evidencia científica como en su utilización a nivel local por los profesionales y las limitaciones en los sistemas de información y análisis de costes sanitarios son barreras a la aplicación de la Práctica Basada en la Evidencia. Detrás de estas barreras, se identifican causas institucionales, de los centros sanitarios y de los propios profesionales.
Conclusiones. Según las causas identificadas, se plantean las siguientes propuestas de mejora: simplificar la selección de fuentes de evidencia científica, facilitar a los profesionales sanitarios el acceso a la evidencia y su participación en redes y proyectos de investigación, reorientar las estrategias de implantación de planes de mejora en los centros sanitarios, e impulsar la evaluación del coste-efectividad de la atención sanitaria.
JUSTIFICACIÓN
Recientemente, se han publicado sendos trabajos que abordan el reto de la sostenibilidad de la prestación de servicios de salud en un contexto de crisis económica como la que vivimos. Así, en mayo de 2011, New England Journal of Medicine, ha publicado una perspectiva titulada Reforming Medicare by Reforming Incentives. Como posibles soluciones, el autor del artículo plantea 12 estrategias para reducir costes en la atención a los pacientes sin que ello suponga menoscabo alguno de la calidad asistencial1.
De las 12 estrategias planteadas, la mitad está relacionada con la llamada Práctica o Medicina Basada en la Evidencia: implantación de buenas prácticas en la prevención de infecciones; sistematización en la atención a enfermedades crónicas para reducir la necesidad de ingreso; gestión basada en resultados; mejora del circuito de evaluación, selección y adquisición de nuevos fármacos y dispositivos médicos; profundizar en la mejora de la calidad y rediseño de los procesos; y disponer de guías de práctica clínica basadas en la evidencia para reducir la variabilidad en la práctica clínica y acelerar la integración de las nuevas evidencias.
En España, Peiró et al. publican en Gaceta Sanitaria los resultados de un panel de expertos creado para desarrollar propuestas para mejorar la eficiencia del Sistema Nacional de Salud. Varias de ellas hacen referencia al impulso de la evaluación de tecnologías sanitarias y medicamentos y su adecuación a la evidencia científica sobre coste-efectividad y efectividad2.
Ambos artículos, inciden en la necesidad de adecuar la tecnología sanitaria a la evidencia científica como estrategia promotora de eficiencia en los servicios de salud. Varios autores, en los últimos años, han abordado el problema del uso de la tecnología y su repercusión en la sostenibilidad de nuestro Sistema Nacional de Salud3.
En primer lugar, aclararemos conceptos: ¿qué entendemos por Práctica Basada en la Evidencia? ¿Y por tecnología sanitaria?
El centro Cochrane Iberoamericano define Medicina Basada en la Evidencia (MBE) como el empleo consciente, explícito y juicioso de la mejor evidencia actual en la toma de decisiones sobre el cuidado sanitario de los pacientes. La Práctica Basada en la Evidencia (PBE) integra la competencia clínica individual con la mejor evidencia clínica externa disponible a partir de la investigación sistemática, es decir, con la MBE.
Tecnología se define en un sentido amplio, incluyéndose en el concepto tanto la tangible, medicamentos y aparatos, como la intangible, que incluye conocimiento e innovaciones en los procedimientos clínicos y quirúrgicos y los cambios organizativos, porque la innovación organizativa es una condición necesaria -aunque no suficiente- para la innovación tecnológica.
Desde el punto de vista de la tecnología tangible, la mayor parte de las nuevas tecnologías son propulsores del gasto sanitario, a corto y a largo plazo, a través de mecanismos diversos. De este modo, se estima que entre el 33% y el 50% del incremento del gasto sanitario se explica por el avance en nuevas tecnologías. Llegados a este punto, la cuestión que se plantea es ¿este aumento del gasto está justificado? ¿Las nuevas tecnologías aportan a la salud y el bienestar de la población más de lo que cuestan? No toda innovación es un adelanto, ni toda innovación mejora la salud, ni toda innovación que puede mejorar la salud es coste-efectiva. Por ello, es indispensable mejorar el circuito de identificación, selección, implantación y evaluación de la evidencia científica en la práctica asistencial3.
Existen, sin embargo, barreras que dificultan este proceso. Podríamos analizar estas limitaciones dentro de las siguientes categorías: problemas en la identificación de la evidencia científica; dificultades para aplicar las recomendaciones a nivel local; y debilidades en los sistemas de información y análisis de costes atribuibles a la asistencia sanitaria.
OBJETIVOS
-Definir las principales barreras que pueden limitar la adecuación de la atención sanitaria a la evidencia científica.
-Describir propuestas de mejora para potenciar la Práctica Basada en la Evidencia en los centros sanitarios.
ESTRATEGIA DE BÚSQUEDA
La búsqueda de artículos se ha realizado a través de tripdatabase, sumsearch, excelencia clínica y google –búsqueda avanzada-. Utilizando estos motores de búsqueda se han identificado referencias sobre artículos originales, de revisión y opinión, utilizando como palabras clave, en castellano y en inglés, medicina basada en la evidencia, adecuación de tecnología sanitaria, información sanitaria, evaluación económica.
La estrategia de búsqueda se ha adaptado a las características de cada una de las bases de datos, quedando restringida a artículos de revisión en las bases de datos médicas y a documentos específicos avalados por instituciones y sociedades científicas españolas en google avanzado. La búsqueda fue realizada en julio de 2011.
SELECCIÓN DE ESTUDIOS Y DE DATOS
Los artículos se seleccionan en función tanto de su relación específica con los objetivos abordados en la presente revisión, como de su actualidad, priorizando aquellos trabajos que presentan una antigüedad inferior a los 3 años.
SÍNTESIS DE RESULTADOS
A continuación definimos los aspectos más relevantes que, de acuerdo con la revisión realizada, pueden dificultar la implantación de la evidencia científica en la práctica clínica:
- Problemas para identificar la evidencia científica En los últimos años, el aumento en el uso de Internet ha facilitado el acceso de los profesionales sanitarios (y de los usuarios) a la información sobre medicina. Sin embargo, en la práctica, este acceso se encuentra muy dificultado por la excesiva información existente en la red. Gisbert JP et al, se refieren a este problema en 20084,5. Si tratamos de informarnos sobre cualquier problema de salud utilizando los motores de búsqueda generales (google, altavista…) posiblemente nos encontraremos con millones de resultados con páginas que proporcionan información de dudosa calidad.Artículos indexados en MEDLINE. Evolución anual 1950-2010
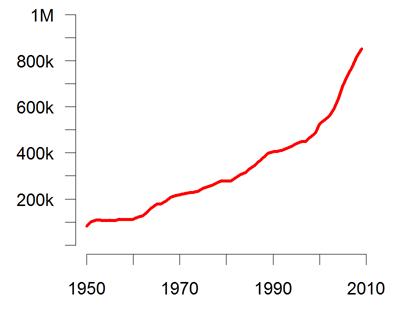
Fuente: www.jasonpriem.com (gráfica realizada a partir de los datos publicados por la US National Library of Medicine)
Incluso si nos limitamos a identificar las fuentes de información específicamente especializadas, subsiste el mismo inconveniente. Así, en MEDLINE, se publican anualmente más de 25.000 revistas y 10 millones de referencias. Gisbert JP et al plantean a modo de ejemplo la introducción del término Crohn’s disease en la casilla de PubMed (motor de búsqueda más conocido de MEDLINE), identificando más de 26.000 referencias bibliográficas relacionadas con esa enfermedad, cifra difícilmente manejable, pues un profesional que intente mantenerse al día sólo en su especialidad debería leer, teóricamente, más de 100 artículos completos cada semana, o más de 500 el día de vuelta de sus vacaciones de verano4,5.
Por todo ello, se hace patente la necesidad de utilizar herramientas que recopilen de forma ágil y actualizada la evidencia científica publicada sobre un tema. Es el caso de la información recopilada a través de revisiones sistemáticas y metaanálisis, y organizada a través de las Guías de Práctica Clínica.
Las revisiones sistemáticas y metaanálisis son investigaciones científicas, realizadas con un método estructurado y sistemático, de recopilación y síntesis de los resultados de artículos originales publicados sobre un determinado tema. En los metaanálisis esta integración de resultados se realiza mediante análisis estadístico4.
Las Guías de Práctica Clínica (GPC) se definen como el conjunto de “recomendaciones desarrolladas de forma sistemática para ayudar a profesionales y pacientes a tomar decisiones sobre la atención sanitaria más apropiada, y a seleccionar las opciones diagnósticas o terapéuticas más adecuadas a la hora de abordar un problema de salud o una condición clínica específica”5.
Sin embargo, a la hora de interpretar los hallazgos de revisiones sistemáticas y metaanálisis debemos ser cautelosos, puesto que están sujetas a posibles sesgos en las diversas etapas de su elaboración. Además, no olvidemos que su realización está limitada por el volumen y calidad de los estudios originales analizados6. En esta línea podemos mencionar los llamados sesgos de publicación. Kirkham et al, recientemente, han demostrado la alta prevalencia de estos sesgos en relación a las variables resultado de los estudios y su impacto en las revisiones realizadas por la Cochrane7. La falta de publicación de resultados no significativos y la difusión de aquellos que puedan resultar de mayor interés para la industria farmacéutica son motivos más que suficientes para extremar la precaución y el rigor en la interpretación de las revisiones8.
Las Guías de Práctica Clínica (GPC), tienen igualmente limitaciones ya que existe variabilidad en la calidad de las mismas, esto es, en la validez y viabilidad de sus recomendaciones9. Existen herramientas para evaluar la calidad de una guía siendo la más utilizada el instrumento AGREE, según el cual se rigen los principales organismos productores y recopiladores de Guías de Práctica Clínica (tabla 1).
Otra de las limitaciones de las GPC es la variablilidad en los criterios de priorización de los temas de salud y tecnologías a abordar por las distintas agencias. Además, como consecuencia de los continuos avances científicos, cada vez más acelerados, existe el riesgo de que las guías publicadas queden obsoletas cada vez en menos tiempo3.
En España, a la hora de difundir la evidencia científica a los profesionales, llegó a existir un problema derivado de la excesiva fragmentación de agencias de evaluación de tecnología sanitaria3. Actualmente, estas agencias, que nacieron originariamente aisladas entre sí, trabajan coordinadamente dentro del proyecto GuiaSalud, cuyo principal objetivo es desarrollar y poner a disposición de las Comunidades Autónomas, instrumentos de información, registro, selección, adaptación, implantación y actualización de Guías de Práctica Clínica.
Fuera de España, existen múltiples agencias de evaluación de tecnología sanitaria, que recopilan y difunden estudios de evaluación económica y Guías de Práctica Clínica. Entre ellas, podríamos citar ejemplos como la NICE (National Institute for Health and Clinical Excellence) en Reino Unido; o el ICSI (Institute for Clinical Systems Improvement) en Estados Unidos.
- Dificultades para aplicar las recomendaciones de la evidencia científica a nivel local. Algunos estudios indican que entre un 30-40% de los pacientes no reciben una atención sanitaria basada en la evidencia científica, y que, incluso, un 20-25% de la atención sanitaria o no es necesaria o puede ser perjudicial10. Esta falta de aplicación en la práctica de la llamada MBE se traduce en desigualdades en el acceso y la atención sanitaria11,12. Así, la asistencia sanitaria que reciben los pacientes depende más del centro sanitario al que acuden que de la evidencia científica que sustenta los cuidados que deben recibir. Unas veces, esta inadecuación se produce por defecto, es decir, no se presta una atención que el paciente debiera recibir y otras, por exceso, cuando se indica una determinada prueba o un tratamiento en pacientes que no lo necesitan. En este último caso, las repercusiones exceden lo puramente asistencial. En un contexto de recursos limitados, Peiró et al describen la obsesión existente en muchos profesionales por el “más es mejor”. Una obsesión que “lleva a aumentar la utilización de intervenciones de beneficio dudoso, mientras no se realizan otras de efectividad demostrada y que, se quiera o no, compiten por los mismos recursos”12.Pero ¿a qué puede deberse esta falta de cumplimiento en la práctica de recomendaciones que están sobradamente avaladas por la evidencia científica? A principios de 2011, Heiwe S et al. nos proporcionan algunas pistas para dar respuesta a esta cuestión. En su artículo, en el que evalúan conocimientos, actitudes y comportamientos de profesionales rehabilitadores y nutricionistas en torno a la evidencia científica, destacan el elevado compromiso de estos profesionales con la aplicación de la PBE, aunque identifican algunas barreras que dificultan su adherencia:
La causa más frecuentemente señalada por estos profesionales es la falta de tiempo para consulta (84%). Le siguen otras como los problemas para interpretar la aplicabilidad de las recomendaciones a la población de pacientes atendidos (37%), y la falta de habilidades tanto de búsqueda bibliográfica (36%), como de análisis estadísticos básicos (33%)13.Más allá de los factores individuales de los profesionales, existen otros factores propios de la organización a la que pertenecen, que pueden influir en que la brecha existente entre conocimiento y acción sea mayor o menor14. Djikstra et al, en un metaanálisis realizado en 2006, llegan a conclusiones interesantes: la adherencia a las recomendaciones de la evidencia científica sobre un determinado proceso asistencial es mayor en centros académicos, mejora si se realiza una adecuada revisión de los perfiles profesionales que intervienen en el proceso y parece aumentar el seguimiento a medida que disminuye el número de servicios y perfiles profesionales implicados. Sin embargo, en contra de lo que en un principio podría apuntarse, el apoyo financiero e institucional ejerce un impacto modesto, aunque existe notable variabilidad entre los diferentes estudios analizados15.
Gillies et al, en 2006, plantean algunas claves para mejorar el seguimiento de los programas asistenciales como son la existencia de objetivos claros en la organización, con incentivos financieros alineados con la mejora de calidad, la condición de ser profesional de staff, asalariado y que trabaja en equipo, y la disponibilidad de registros clínicos electrónicos y software que facilitan el seguimiento de pacientes y proporcionan información a los profesionales sobre el impacto de sus decisiones16.
Otras estrategias utilizadas para aumentar el grado de implantación de la evidencia científica en las organizaciones sanitarias han demostrado tener un impacto débil o moderado. De este modo, Grimshaw et al, en una ambiciosa revisión del Health Technology Assessment Programme, describen la notable variabilidad de resultados que produce la implantación de medidas como la distribución de materiales, la participación en actos formativos, los procesos locales de consenso, la opinión de líderes locales, las intervenciones mediadas por pacientes, el audit con feedback, los recuerdos, el marketing, el uso de medios de comunicación de masas, y cualquier combinación de las anteriores (intervenciones multifacéticas)17.
Por último, merece mención aparte el llamado “fenómeno de convergencia”. Demostrado empíricamente por Bikhchandani y Chandra en 2002, se basa en la tendencia de los profesionales a aprender, más allá de sus propias experiencias, de las de otros profesionales de su entorno en los que confían18. Este fenómeno, puede ser de utilidad para lograr el éxito en la difusión de buenas prácticas, ya que las prácticas en entornos cercanos tienden a converger. De esta manera, la implantación de un plan de mejora en un servicio concreto de un centro sanitario, no se limitaría a dicho servicio, sino que tendría repercusiones positivas en toda la organización.
- Limitaciones de los sistemas de información y análisis de costes.
En España, a los problemas citados anteriormente, hay que añadir que la información sobre los costes de producción de servicios sanitarios es aún precaria. La contabilidad analítica está poco desarrollada, existiendo una falta de normalización que dificulta la comparación entre diferentes centros.
Por otro lado, el sistema de información del SNS se desarrolla con lentitud, tanto en la definición como en la selección de los indicadores clave que permitan medir la eficiencia de la atención sanitaria. La excesiva fragmentación y descentralización de este sistema de información, es una barrera para la evaluación de esos indicadores clave y limita la posibilidad de realizar comparaciones no solo entre Comunidades Autónomas, sino, dentro de una misma Comunidad, entre diferentes centros sanitarios. Además, uno de los aspectos claves que promueven una mayor adherencia de los profesionales sanitarios a la evidencia científica, es que estos cuenten con sistemas de información capaces de proporcionar datos fiables, válidos y en el menor tiempo posible, sobre el impacto que tienen sus cuidados en la calidad de la asistencia sanitaria3.
En España, es necesario disponer de un sistema de información integrado, que supere las actuales limitaciones del fraccionamiento existente a nivel regional. Por otro lado, se deben ampliar las bases de información de los actuales cuadros de mando utilizados por los diferentes SRS para que los sistemas de indicadores aporten información sobre resultados en salud, calidad percibida o igualdad de acceso19.
CONCLUSIONES Y RECOMENDACIONES
La revisión planteada, ha identificado tres tipos de barreras que pueden limitar la implantación de la evidencia científica a la práctica asistencial:
- Limitaciones metodológicas en la identificación de la evidencia científica. Los profesionales se enfrentan a un exceso creciente de literatura científica que dificulta que se mantengan al día. El desarrollo de revisiones sistemáticas, y metaanálisis y la organización de la evidencia en Guías de Práctica Clínica pueden facilitar este proceso. No obstante, la calidad metodológica de estas revisiones y guías debe ser verificada con cautela.
- Dificultades para “pasar de la teoría a la práctica”, es decir, para que recomendaciones suficientemente avaladas por la evidencia científica se apliquen por los profesionales a nivel local. Algunos factores asociados a esta falta de adherencia a la evidencia son individuales (falta de tiempo y de formación para búsqueda en Internet) y otros son de organizacionales (alcance de los procesos, falta de acreditación docente, carencia de sistemas de seguimiento,…).
- Limitaciones de los sistemas de información y análisis de costes. Aunque en los últimos años se han experimentado notables avances, en España la información sobre costes asociados a la atención sanitaria es aún pobre. Por otro lado, el sistema de información del SNS se desarrolla con lentitud, tanto en la definición como en la selección de los indicadores clave.
- Propuestas de mejora.
- Simplificar la selección de fuentes de conocimiento de la evidencia científica tanto españolas (proyecto GuíaSalud) como internacionales (NICE, ICSI,…). Proponemos una relación de fuentes para búsqueda de la práctica basada en la evidencia científica (buscadores, organismos compiladores y productores de Guías de Práctica Clínica, y centros de Evidencia (tabla 1).
- Facilitar el acceso de los profesionales a la evidencia científica. Promoviendo la conciliación de la actividad asistencial con la investigadora y potenciando la formación de los profesionales en búsqueda, selección e interpretación de la evidencia científica. Promoviendo, además, la participación en proyectos y en redes nacionales e internacionales y agilizando los circuitos que seleccionan y ponen a disposición de los profesionales sanitarios la evidencia científica disponible. El boletín de Apuntes de Ciencia y el proyecto de gestión del conocimiento del Hospital General de Ciudad Real (HGUCR) son buenos ejemplos de ello.
- Reorientar las estrategias de implantación de planes de mejora en los centros sanitarios. Aumentando la implicación de los profesionales en su desarrollo y el trabajo en equipo, incorporando en la medida de lo posible a especialistas en formación, priorizando aquellos proyectos que impliquen a un menor número de servicios, incentivando el logro de objetivos, etc.
- Impulsar la evaluación del coste-efectividad de la atención sanitaria. Desarrollando sistemas de información sanitaria ágiles y sencillos y fomentando la evaluación del impacto que tiene la implantación de nuevos planes y tecnologías en la atención sanitaria. La adherencia de los profesionales a la evidencia científica y su concienciación con el buen uso de la tecnología sanitaria pasa porque éstos dispongan de datos fiables, y en el menor tiempo posible, acerca de la efectividad e impacto económico sobre el sistema que tiene su práctica asistencial.
BIBLIOGRAFÍA
1.Enthoven AC. Reforming Medicare by Reforming Incentives. NEJM, 2011: e44(1-3).
2.Peiró S, Artells JJ, Meneu R. Identificación y priorización de actuaciones de mejora de la eficiencia en el Sistema Nacional de Salud. Gac Sanit. 2011;25(2):95–105.
3.González-López-Valcárcel B. La incorporación de nuevas tecnologías en el Sistema Nacional de Salud. Coste-efectividad y presiones sobre el gasto sanitario. Presupuesto y Gasto Público, 2007; 49:87-105.
4.Gisbert JP, Bonfill X. ¿Cómo realizar, evaluar y utilizar revisiones sistemáticas y metaanálisis? Gastroenterol Hepatol 2004;27(3):129-49.
5.Gisbert JP, Alonso-Coello P, Piqué JM ¿Cómo localizar, elaborar, evaluar y utilizar guías de práctica clínica? Gastroenterol Hepatol. 2008;31(4):239-57.
6.Letelier LM, Manríquez JJ, Rada G. Revisiones sistemáticas y metaanálisis: ¿son la mejor evidencia? Rev Méd Chile 2005; 133: 246-249.
7.Kirkham JJ, Dwan KM, Altman DG et al. The impact of outcome reporting bias in randomised controlled trials on a cohort of systematic reviews. BMJ 2010;340-365.
8.Greenhalgh T. How to read a paper. Papers that summarise other papers (systematic reviews and metaanalyses). BMJ 1997;315:672–5.
9.Navarro-Puerto MA, Ruiz-Romero F, Reyes-Domínguez A et al. ¿Las guías que nos guían son fiables? Evaluación de las guías de práctica clínica españolas. Rev Clin Esp. 2005;205(11):533-40.
10.Grol R, Grimshaw J. From best evidence to best practice: effective implementation of change in patients’ care. Lancet 2003;362:1225-30.
11.Peiró S, Librero J, Ridao M. Variabilidad en la utilización de los servicios de urgencias hospitalarios del Sistema Nacional de Salud. Gac Sanit.2010;24(1):6–12.
12.Peiró S, Meneu R, Bernal-Delgado E. Variabilidad, efectividad y desigualdad. Histerectomías y prostatectomías por enfermedad neoplásica en España (2002-2004). Rev Esp Salud Pública 2009; 83: 109-121.
13.Heiwe S, Kajermo KN, Tyni-Lenné R et al. Evidence-based practice: attitudes, knowledge and behaviour among allied health care professionals. Int J Qual Health Care, 2011; 1-12.
14.Bernal-Delgado E. ¿Cómo mejorar la efectividad (calidad) reduciendo la brecha de la investigación a la acción? Informe SESPAS 2008. Gac Sanit. 2008;22 (1):20-6.
15.Dijkstra R, Wensing M, Thomas R, et al. The relationship between organisational characteristics and the effects of clinical guidelines on medical performance in hospitals: a meta-analysis. BMC Health Services Research. 2006; 6-53.
16.Gillies RR, Chenok KE, Shortell SM, et al. The impact of Health Plan Delivery System Organization on Clinical Quality and Patient Satisfaction. Health Serv Res. 2006;41:1181-99.
17.Grimshaw JM, Thomas RE, MacLennan G, et al. effectiveness and efficiency of guideline dissemination and implementation strategies. Health Technol Assess. 2004:8 (6).
18.Bikhchandani S, Chandra A, Goldman DP, et al. The economics of iatroepidemics and quakeries: physician learning, informational cascades and geographic variation in medical practice. Washington, DC: Department of Economics Working Paper; 2002.
19.Martín JJ, López del Amo MP. La medida de la eficiencia en las organizaciones sanitarias. Presupuesto y Gasto Público 2007;49:139-161.
p { margin-bottom: 0.21cm; }a:link { color: rgb(0, 0, 255); }
TABLA 1. DIRECCIONES ELECTRÓNICAS PARA BÚSQUEDA DE LA EVIDENCIA CIENTÍFICA
| Buscadores de Práctica Basada en la Evidencia | |
| Tipdatabase | http://www.tripdatabase.com |
| Sumsearch | http://sumsearch.uthscsa.edu/espanol.htm |
| Excelencia Clínica | http://www.excelenciaclinica.net/ |
| Joanna Briggs Institute | http://www.joannabriggs.edu.au/ |
| http://www.google.es | |
|
Organismos compiladores de Guías de Práctica Clínica |
|
| National Guideline Clearinghouse (NGC) | http://guidelines.gov/ |
|
Guidelines International Network (G-I-N) |
http://www.g-i-n.net/ |
|
Nacional Library for Health (NLH) |
http://www.evidence.nhs.uk/ |
| Organismos productores de Guías de Práctica Clínica | |
| Biblioteca de Guías de Práctica Clínica del SNS (Guía Salud) |
|
|
National Institute for Healthcare and Clinical Excellence (NICE) |
|
|
Institute for Clinical Systems Improvement (ICSI) |
http://www.icsi.org/ |
|
Agency for Healthcare Research and Quality (AHRQ) |
|
|
Scottish Intercollegiate Guidelines Network (SIGN) |
|
|
New Zealand Guidelines Group (NZGG) |
http://www.nzgg.org.nz/ |
| Singapore Ministry of Health | http://www.moh.gov.sg/mohcorp/publications.aspx |
| Centros de Práctica Basada en la Evidencia | |
| Center for Evidence Based Medicine –Oxford- (CEBM) |
|
| The Cochrane Collaboration | http://www.cochrane.org |
| Biblioteca Cochrane Plus | http://www.update-software.com/Clibplus/ClibPlus.asp |
| Fisterra MBE | http://www.fisterra.com/mbe/ |
| Infodoctor | http://www.infodoctor.org/rafabravo/mbe.htm |
Fuente: elaboración propia.
BIBLIOGRAFÍA
-
Enthoven AC. Reforming Medicare by Reforming Incentives. NEJM, 2011: e44(1-3).
-
Peiró S, Artells JJ, Meneu R. Identificación y priorización de actuaciones de mejora de la eficiencia en el Sistema Nacional de Salud. Gac Sanit. 2011;25(2):95–105.
-
González-López-Valcárcel B. La incorporación de nuevas tecnologías en el Sistema Nacional de Salud. Coste-efectividad y presiones sobre el gasto sanitario. Presupuesto y Gasto Público, 2007; 49:87-105.
-
Gisbert JP, Bonfill X. ¿Cómo realizar, evaluar y utilizar revisiones sistemáticas y metaanálisis? Gastroenterol Hepatol 2004;27(3):129-49.
-
Gisbert JP, Alonso-Coello P, Piqué JM ¿Cómo localizar, elaborar, evaluar y utilizar guías de práctica clínica? Gastroenterol Hepatol. 2008;31(4):239-57.
-
Letelier LM, Manríquez JJ, Rada G. Revisiones sistemáticas y metaanálisis: ¿son la mejor evidencia? Rev Méd Chile 2005; 133: 246-249.
-
Kirkham JJ, Dwan KM, Altman DG et al. The impact of outcome reporting bias in randomised controlled trials on a cohort of systematic reviews. BMJ 2010;340-365.
-
Greenhalgh T. How to read a paper. Papers that summarise other papers (systematic reviews and metaanalyses). BMJ 1997;315:672–5.
-
Navarro-Puerto MA, Ruiz-Romero F, Reyes-Domínguez A et al. ¿Las guías que nos guían son fiables? Evaluación de las guías de práctica clínica españolas. Rev Clin Esp. 2005;205(11):533-40.
-
Grol R, Grimshaw J. From best evidence to best practice: effective implementation of change in patients’ care. Lancet 2003;362:1225-30.
-
Peiró S, Librero J, Ridao M. Variabilidad en la utilización de los servicios de urgencias hospitalarios del Sistema Nacional de Salud. Gac Sanit.2010;24(1):6–12.
-
Peiró S, Meneu R, Bernal-Delgado E. Variabilidad, efectividad y desigualdad. Histerectomías y prostatectomías por enfermedad neoplásica en España (2002-2004). Rev Esp Salud Pública 2009; 83: 109-121.
-
Heiwe S, Kajermo KN, Tyni-Lenné R et al. Evidence-based practice: attitudes, knowledge and behaviour among allied health care professionals. Int J Qual Health Care, 2011; 1-12.
-
Bernal-Delgado E. ¿Cómo mejorar la efectividad (calidad) reduciendo la brecha de la investigación a la acción? Informe SESPAS 2008. Gac Sanit. 2008;22 (1):20-6.
-
Dijkstra R, Wensing M, Thomas R, et al. The relationship between organisational characteristics and the effects of clinical guidelines on medical performance in hospitals: a meta-analysis. BMC Health Services Research. 2006; 6-53.
-
Gillies RR, Chenok KE, Shortell SM, et al. The impact of Health Plan Delivery System Organization on Clinical Quality and Patient Satisfaction. Health Serv Res. 2006;41:1181-99.
-
Grimshaw JM, Thomas RE, MacLennan G, et al. effectiveness and efficiency of guideline dissemination and implementation strategies. Health Technol Assess. 2004:8 (6).
-
Bikhchandani S, Chandra A, Goldman DP, et al. The economics of iatroepidemics and quakeries: physician learning, informational cascades and geographic variation in medical practice. Washington, DC: Department of Economics Working Paper; 2002.
-
Martín JJ, López del Amo MP. La medida de la eficiencia en las organizaciones sanitarias. Presupuesto y Gasto Público 2007;49:139-161.














Palabras Clave: Evidence Based Medicine, Health Care Economics, Health Information Technology, Technology Assessment