Puente Miocárdico Sintomático
Rodríguez-B. Aguirre R, Mayoralas Palomo Mª V, Sánchez-Maroto Lozano T, Cardenete Aljama M A. Servicio de Urgencias del Hospital General Universitario de Ciudad Real
RESUMEN
Aunque la mayoría de las situaciones de dolor torácico con características isquémicas resultan ser secundarias a lesiones coronarias, algunas tienen un origen diferente. Presentamos un caso de síndrome coronario agudo, con elevación del segmento ST, producido por un puente de tejido miocárdico sobre la arteria descendente anterior. Discutimos la fisiopatología, la clínica y las estrategias terapéuticas de esta entidad, cuyo diagnóstico precoz es importante por que el tratamiento y el pronóstico son considerablemente diferentes.
Palabras clave: Síndrome coronario agudo, puente miocárdico, urgencias
ABSTRACT
Although the majority of situations of chest pain with ischemic characteristics turn out to be secondary to Coronary lesions, some have a different origin. We present a produced by a bridge of myocardial tissue on the anterior descending artery ST segment elevation acute coronary syndrome. We discussed the pathophysiology, clinical and therapeutical strategies of this entity, whose early diagnosis is important because the treatment and prognosis are considerably different.
Key words: Acute coronary syndrome, myocardial bridging, emergency.
INTRODUCCIÓN
El miocardio es un tejido eminentemente aerobio que necesita de la circulación sanguínea para cumplir su función contráctil. Su irrigación se produce a través del árbol coronario, que consta de arterias principales epicárdicas (arterias coronarias derecha e izquierda, descendente anterior, circunfleja,…) y ramas que penetran en el miocardio. La reducción de la presión de perfusión produce una deprivación de oxígeno a nivel tisular, que condiciona fenómenos de isquemia y puede llegar a la necrosis. La causa más común es la arteriosclerosis de las arterias coronarias principales (casi el 95%), pero existen situaciones que comprometen el flujo coronario con arterias angiográficamente normales, como puentes miocárdicos (PM), vasoespasmo y el síndrome de Tako-Tsubo, entre otras. Conocer y diagnosticar precozmente estas entidades supone la aplicación de un tratamiento específico que puede condicionar su pronóstico.
PRESENTACIÓN DEL CASO
Se presenta el caso de un varón de 60 años que acudió a urgencias, de forma autónoma, por dolor torácico no traumático. En el triaje se realizó electrocardiograma (ECG), que fue valorado como normal (Figura1).
Al ser interrogado refirió varios episodios, en las últimas 48 horas, de dolor torácico de perfil coronario (opresivo e irradiado a cuello y brazo izquierdo), no se acompañaban de cortejo vegetativo y no tenían una clara relación con el ejercicio ni con las posturas, que cedían en pocos minutos con nitroglicerina (NTG) administrada por vía sublingual (sl). El último episodio había sido en reposo, 30 minutos antes, y había mejorado con NTG en menos de 5 minutos.
Entre los antecedentes personales destacaban: hipertensión arterial (HTA) de larga evolución; Poliposis adenomatosa familiar (S. de Gardner) con pancolectomía en 1976 y portador de ileostomía terminal; Síndrome de malabsorción con ferropenia crónica; Episodios de insuficiencia renal prerrenal por pérdidas digestivas y antiinflamatorios no esteroideos; Cardiopatía isquémica, desde 2002, tipo angina de esfuerzo con umbral variable, acompañada de episodios de ángor nocturno y síncopes. En la coronariografía, realizada en noviembre de 2002, se observó una lesión excéntrica moderada (60-70%) en la arteria descendente anterior (ADA) proximal y una lesión larga e irregular leve (50%) en la ADA media, con buen lecho distal, no portador de stent. Seguía tratamiento con: Ácido acetil salicílico (AAS) 100 mg/24h; Enalapril 10 mg/24h; NTG transdérmica 15 mg/24h; Carvedilol 25 mg/24h; Alopurinol 100 mg/24h; Pantoprazol 40 mg/24h; Sulfato Ferroso 256,3 mg/24h.
En la exploración física mostraba: tensión arterial: 119/77 mm Hg; frecuencia cardíaca: 62 latidos por minuto; frecuencia respiratoria: 16 respiraciones por minuto; temperatura: 36ºC; saturación de oxihemoglobina: 97% (respirando aire ambiente). Presentaba buen estado general, estaba consciente y orientado, el peso aproximado era de 90 kilogramos (Kg) con una altura de 1,65 metros, las mucosas orales estaban secas y se encontraba bien perfundido. No había ingurgitación yugular, las carótidas eran normales. La auscultación cardiopulmonar no mostraba hallazgos patológicos. En el abdomen destacaba una bolsa de ileostomía en fosa iliaca derecha, con dolor leve difuso a la palpación, tenía el peristaltismo conservado, sin defensa ni signos de irritación peritoneal. En las extremidades no había edemas ni signos de trombosis venosa profunda, los pulsos periféricos eran palpables y simétricos.
Con estos datos, el diagnóstico inicial fue de dolor torácico de perfil coronario en paciente con antecedentes de cardiopatía isquémica, sin dolor actual y con ECG normal, y se estableció el siguiente plan: 1) Se solicitó radiografía (Rx) de tórax y analítica con enzimas cardíacas 2) Pasó a una cama de observación con monitorización; 3) Se instauró tratamiento inicial con: O2 por gafas nasales a 2 litros por minuto; clopidogrel 300 mg por vía oral (VO); enoxaparina 60 mg (0,66 mg/Kg) por vía subcutánea y pantoprazol 40 mg por vía intravenosa (IV).
Se realizaron las pruebas complementarias y en la Rx de tórax no había hallazgos patológicos; el hemograma y el estudio de coagulación eran normales; en la bioquímica destacaban: urea 206 mg/dl, creatinina 3,8 mg/dl, GOT 48 UI/L, GPT 108 UI/L, CPK 297 UI/L (CK-MB 11,5 ng/mL), LDH 141 UI/L, troponina I: 0,08 ng/ml. El sistemático de orina reveló un sedimento normal, con Na+ en orina < 5 mmol/l y una fracción de excreción de Na+ <1.
Los diagnósticos iniciales fueron de síndrome coronario agudo sin elevación del segmento ST (SCASEST) e insuficiencia renal prerrenal por pérdidas digestivas crónicas y se cursaron interconsultas a cardiología y nefrología. El cardiólogo recomendó añadir NTG IV y repetir las enzimas cardíacas. El nefrólogo indicó fluidoterapia iv y valoración analítica posterior.
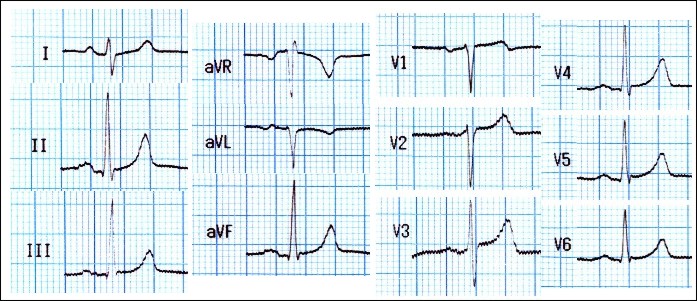
Aproximadamente 2 horas después, el paciente comenzó con dolor anginoso y alteraciones del segmento ST visibles en el monitor. Se realizaron ECG seriados que, coincidiendo con el dolor mostraron elevación del segmento ST, >2 mm, en las derivaciones de la cara inferior (II, III y aVF) y la cara lateral (V4 a V6), con descenso en I, aVL, V1 y V2. Se administraron 2 mg de cloruro mórfico iv y 0,4 mg de NTG IV. Cuando cedió el dolor el ECG se normalizó (Figura 2).
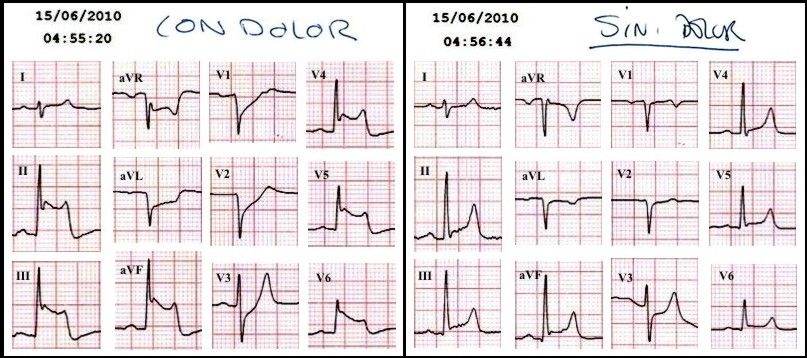
Figura 2. ECG seriados en menos de 2 minutos: “con dolor” (izquierda) compatible con SCACEST; “sin dolor” (derecha) con trazado prácticamente normal.
Ante la nueva situación de síndrome coronario agudo con elevación del segmento ST (SCACEST), se consultó con los servicios de UCI y Hemodinámica, realizándose una coronariografía urgente que mostró codominancia, las arterias coronarias no presentaban lesiones angiográficamente significativas, imagen de “milking” de grado moderado-grave sobre el 1/3 medio de la ADA, la función sistólica del ventrículo izquierdo (VI) estaba conservada, con una fracción de eyección del ventrículo izquierdo observada del 75%.
Al volver a las camas de observación de urgencias, se suspendió la perfusión IV de NTG y se inició tratamiento con atenolol, 50 mg/12h por vi. El paciente evolucionó favorablemente, presentando algunos episodios de dolor con alteraciones transitorias en el ECG, disminuyendo progresivamente en frecuencia e intensidad.
Ingresó en UCI, donde se añadió al tratamiento Amlodipino 5 mg/24h VO por la posibilidad de vasoespasmo asociado. Pasó después a la planta de cardiología y fue dado de alta 8 días después, tras mantenerse estable y asintomático. Ha seguido revisiones en cardiología y, 5 meses después, no ha presentado nuevos eventos coronarios.
Los diagnósticos finales al alta fueron: SCACEST ínfero-lateral; Puente miocárdico con “milking” moderado-grave en ADA media; Insuficiencia renal prerrenal.
DISCUSIÓN
Los puentes miocárdicos (PM) son una anomalía congénita en la que un segmento de una arteria coronaria principal, de habitual trayecto epicárdico, transcurre dentro del espesor del miocardio, describiendo un curso intramural (Figura 3). En esta situación, durante la sístole miocárdica, la arteria puede sufrir una disminución variable de su calibre por compresión, que puede llegar al colapso1.
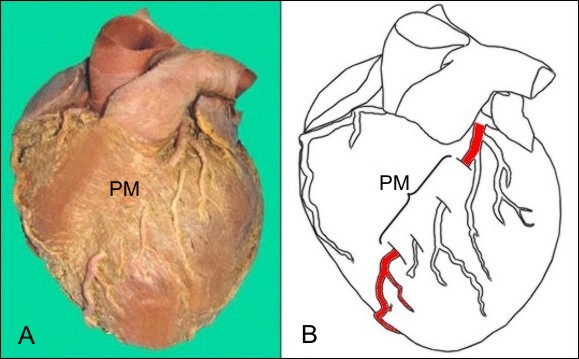
Figura 3. Puente Miocárdico (PM) en arteria descendente anterior. Imagen de necropsia (A); Esquema (B). (Modificado de: Fazliogullari Z et al)
Las primeras identificaciones en autopsias se atribuyen a Reyman en 1737 y a Black en 18051,2. Fueron descritos en angiografía en 1960, por Portmann-Iwig, y en 1976 se describió el efecto ordeñe o “milking”, que constituye la clave de su fisiopatología1,9.
La prevalencia de esta patología es variable, depende del método diagnóstico: En necropsias oscila entre 15-85% y en angiografías 0,5-16%2. La diferencia se justifica porque no todos los PM producen contracción (fenómeno “milking”) detectable durante la angiografía. Son algo más frecuentes en varones (60%)4 y la edad media del diagnostico es 51 años (rango de 14 a 84 años)5.
Generalmente, se asientan sobre una sola arteria, sobre todo la descendente anterior (65-77%), especialmente en su 1/3 medio (59%), seguida de la arteria circunfleja (13-23%) y de las ramas diagonales de la ADA (11%) y marginales de la arteria circunfleja (10%). La afectación de la arteria coronaria derecha resulta excepcional2,3,9.
La fisiopatología se explica porque la arteria coronaria afectada sufre estenosis/colapso durante la sístole ventricular que, cuando es importante, compromete el inicio de la diástole (fase predominante de perfusión miocárdica) y condiciona fenómenos de isquemia distal. Los mecanismos implicados son la disminución de la reserva de flujo coronario (CFR) y el aumento de la velocidad de flujo diastólico/sistólico (DSVR), agravados en situaciones de taquicardia y de vasodilatación coronaria1,3,7.
Aunque la mayoría son silentes, la sintomatología deriva del grado de compromiso del flujo coronario y pueden asociarse a angina, arritmias, bloqueo AV, depresión de la función del VI, aturdimiento miocárdico, infarto agudo de miocardio (IAM) y muerte súbita1,3. Las formas más graves se relacionan con PM más profundos y de mayor longitud y con la coexistencia de otras causas de isquemia coronaria como aterotrombosis, vasoespasmo, hipertrofia ventricular, valvulopatías, HTA,… Como factores asociados con peor pronóstico se han descrito la cardiomiopatía hipertrófica y el grado de estenosis sistólica-diastólica producida por el PM1,5.
El método diagnóstico de referencia es la coronariografía, donde se observa un segmento de una arteria coronaria principal que se estenosa o se colapsa durante la sístole y recupera su tamaño durante la diástole1,2. Esta diferencia de calibre descarta la placa ateromatosa que causa estenosis fija, y el espasmo coronario sin relación con el ciclo cardíaco (Figura 4). El fenómeno “milking” se acentúa con la administración intracoronaria de nitroglicerina (vasodilatación coronaria) o con la perfusión de fármacos inotropos positivos como la dobutamina (aumento del grado de compresión). De esta forma se incrementa considerablemente la sensibilidad de esta prueba diagnóstica3.
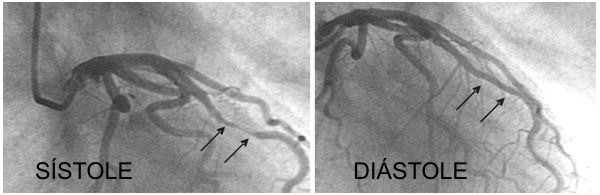
Figura 4. Coronariografía que muestra compresión de la ADA (flechas), por un PM, en SÍSTOLE (izquierda) y relajación de la misma en DIÁSTOLE (derecha).(Modificado de: Pyung Jin Kim et al)
Se han utilizado otras técnicas invasivas para el diagnóstico de los PM, como la ecografía intravascular, que muestra una imagen en “media luna” altamente específica (área ecolúcida que rodea al PM durante el ciclo cardíaco)1,2, y el eco-doppler intracoronario, donde aparece una imagen característica en “punta de dedo” (aceleración del flujo durante la protodiástole seguida de una desaceleración mesodiastólica “en plateau”, durante la sístole el flujo se reduce drásticamente y, en ausencia de taquicardia, se observa un flujo retrógrado a la entrada del PM)1,2,3.
La angiografía coronaria por tomografía computarizada multidetector (ACTCM) (Figura 5) ha supuesto una alternativa no invasiva para la evaluación de las arterias coronarias, que permite, entre otras posibilidades, detectar la presencia de PM, clasificarlos y determinar su comportamiento durante el ciclo cardíaco4,5,9.
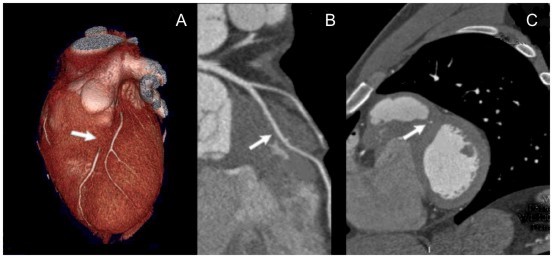
Figura 5. ACTCM con PM sobre arteria coronaria descendente anterior (flechas). Reconstrucciones: A) tridimensional; B) sagital; C) transversal. (Modificado de: Martin M y col)
Otras pruebas diagnósticas, como electrocardiograma, ergometría y perfusión miocárdica por cámara gamma, pueden ayudar a encontrar áreas de isquemia o necrosis producidas por PM, pero no aseguran su diagnóstico. La resonancia nuclear magnética (RNM) puede ser útil en el diagnóstico y la localización del PM, aunque su solicitud es rara en esta entidad.
El tratamiento depende de la clínica. Sólo se tratan los pacientes sintomáticos, para los que existen estrategias basadas en tratamiento médico, percutáneo y quirúrgico1. La primera línea de tratamiento médico son los betabloqueantes1,7,8. Sus efectos inotrópico y cronotrópico negativos disminuyen la compresión arterial y alargan el ciclo cardíaco, mejorando los síntomas y signos ocasionados por el PM. Los antagonistas de los canales del calcio se usan cuando están contraindicados los betabloqueantes o cuando se asocia un componente de vasoespasmo. Casi siempre se añaden antiagregantes plaquetarios para prevenir posibles eventos coronarios por aterotrombosis1,6. Los nitratos se consideran contraindicados, aunque se encontraron eficaces en algunos pacientes (posiblemente por su capacidad de reducir el vasoespasmo), se sabe que su uso intracoronario acentúa la estenosis sistólica y el fenómeno “milking”1,7.
La intervención coronaria percutánea es otra opción terapéutica en los pacientes sintomáticos. Está indicada en situaciones de fracaso del tratamiento médico y para evitar la cirugía. La colocación de un stent en la zona del “milking” puede revertir las alteraciones hemodinámicas locales que causan la isquemia y mejorar la reserva coronaria1,6,7.
La cirugía con miotomía del PM consiste en el clivaje de las fibras musculares que cubren la arteria coronaria. Es una técnica más invasiva que la angioplastia y con los inconvenientes derivados de la cirugía con circulación extracorpórea, de la toracotomía y de la dificultad técnica7,8. Como alternativa quirúrgica, el bypass de mamaria interna con ADA puede ser la opción terapéutica en los pacientes que no responden al stent coronario o con reestenosis del mismo1,6,8.
A pesar de los casos descritos de complicaciones graves, el pronóstico general de los pacientes con PM es bueno y puede considerarse una patología relativamente benigna. Sin embargo, la mayoría necesitan tratamiento durante mucho tiempo e incluso de forma crónica7.
CONCLUSIONES
La importancia de este caso radica en el diagnóstico de una causa poco habitual de síndrome coronario, que puede causar IAM, arritmias graves y muerte súbita en pacientes con arterias coronarias normales y donde la clásica administración de nitroglicerina, paradójicamente, puede ser perjudicial para el aporte de O2 al miocardio.
Descritos hace más de 300 años, los PM permanecen subdiagnosticados, lo que se demuestra por la diferente prevalencia en autopsias y coronariografías.
Aunque habitualmente tiene buen pronóstico, esta entidad puede ocasionar graves consecuencias, por lo que debe recordarse ante una clínica de isquemia o arritmia con ECG cambiante, para conseguir un diagnóstico temprano e instaurar una estrategia terapéutica apropiada.
BIBLIOGRAFÍA
- Bourassa M, Butnaru A, Lespérance J, Tardif J-C. Symptomatic myocardial bridges: Overview of ischemic mechanisms and current diagnostic and treatment strategies. Am J Cardiol 2003; 41: 351-359
- Fazliogullari Z, Kagan A, Kayrak M, Ilknur I. Investigation and review of myocardial bridges in adult cadaver hearts and angiographs. Surg Radiol Anat 2010; 32: 437-445.
- Hazenberg AJC, Jessurum GAC, Tio RA. Mechanisms involved in symptomatic myocardial bridging. Netherlands Heart Journal Volume 16, Number 1, January 2008.
- Pyung Jin Kim, Gham Hur, Su Young Kim. Frequency of myocardial bridge and dynamic compression of epicardial coronary arteries. A comparison between computed tomography and invasive coronary angiography. Circulation 2009; 119: 1408-1416.
- Javadrashid R, Tarzamni MK, Aslanabadi N, Ghaffari M, Salehi A, Sorteji K. Myocaridal bridging and coronary artery anomalies detected by ECG-gated 64-row multidetector computed tomography angiography in syntomatic patients. Folia Morphol 2009; 68, 4:201-206.
- Gomberg-Maitland M, Kim MC, Fuster V. A stratified approach to the treatment of a symptomatic myocardial bridge. Clin Cardiol 2002; 25: 484-486.
- Íñigo JA, López R, Pinar E, Picó F, Valdés M y col. Pronóstico a largo plazo de los pacientes con trayecto intramiocárdico de la arteria descendente anterior con compresión sistólica. Rev Esp Cardiol 2002; 55(4): 359-364.
- Xiao-Hong H, Shui-Yun W, Jian-Ping X, Yun-Hu S, Han-Song S, Yue T. Surgical outcome and clinical follow-up in patients with symptomatic myocardial bridgind. Chin Med J 2007; 120 (18): 1563-1566.
- Carrascosa P, Martín E, Capuñay C, Deviggiano A, Vallejos J, Carrascosa J. Prevalencia y características de los puentes miocárdicos en estudios de angiografía coronaria por tomografía computarizada multidetector. Rev Argent Cardiol 2009; 77: 268-273.














Palabras Clave: Acute coronary syndrome, emergency, myocardial bridging, puente miocárdico, Síndrome coronario agudo, urgencias